
- •Содержание
- •1. Введение.
- •1.1 Общие закономерности химических процессов. Классификация процессов общей химико-технологических процессов
- •Требования к химическим производствам
- •Компоненты химического производства
- •Разделение на две твердые фазы:
- •Разделение жидкости и твердого вещества:
- •1.2 Промышленный катализ
- •Основные положения теории катализа.
- •1.3. Сырьевая база химической промышленности.
- •Классификация сырья
- •Характеристика минерального сырья
- •Химическое сырье
- •Растительное и животное сырье
- •Характеристика разработок минерального сырья
- •Качество сырья и методы его обработки
- •Способы сортировки:
- •Способы обогащения:
- •Сырьевая база химических производств
- •1.4 Энергетическая база химических производств
- •1.5 Критерии оценки эффективности производства
- •1.5.1. Интегральные уравнения баланса материальных потоков в технологических процессах. Понятие о расходных коэффициентах. Относительный выход продукта
- •1.5.2. Балансы производства
- •1. Материальный баланс
- •2. Энергетический (тепловой) баланс
- •3. Экономический баланс
- •1.5.3. Технологические параметры химико-технологических процессов.
- •1.6.Принципы создания ресурсосберегающих технологий
- •2. Теоретические основы химической технологии
- •2.1. Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
- •2.2 Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена.
- •Молекулярная диффузия. Первый закон Фика
- •Турбулентная диффузия
- •Уравнение массоотдачи
- •Уравнение массопередачи
- •Связь коэффициента массопередачи и коэффициентов массоотдачи (или уравнение аддитивности фазовых сопротивлений)
- •Подобие массобменных процессов
- •3. Химическое производство как сложная система. Иерархическая организация процессов в химическом производстве
- •3.1. Химико-технологические системы (хтс). Элементы хтс. Структура и описание хтс. Методология исследования хтс, синтез и анализ хтс.
- •Методология исследование химико-технологических систем.
- •3.2. Сырьевая и энергетическая подсистема хтс
- •1. Классификация химических реакторов по гидродинамической обстановке.
- •2. Классификация химических реакторов по условиям теплообмена.
- •3. Классификация химических реакторов по фазовому составу реакционной массы.
- •4. Классификация по способу организации процесса.
- •5. Классификация по характеру изменения параметров процесса во времени.
- •6. Классификация по конструктивным характеристикам.
- •3.4. Промышленные химические реакторы. Реакторы для гомогенных процессов, гетерогенных процессов с твердой фазой, гетерогенно-каталитических процессов, гетерофазных процессов.
- •Реакторы для гетерогенных процессов с твердой фазой.
- •Реакторы для гетерогенно-каталитических процессов.
- •4. Основные математические модели процессов в химических реакторах
- •4.1. Идеальные химические реакторы. Непрерывный реактор идеального вытеснения. Непрерывный реактор идеального смешения
- •4.2. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. Обоснование использования каскада реакторов.
- •Каскад реакторов смешения.
- •Влияние степени конверсии.
- •Влияние температуры.
- •5. Применение кинетических моделей для выбора и оптимизации условий проведения процессов
- •5.1. Экономические критерии оптимизации и их применение для оптимизации реакционных узлов.
- •Оптимальные концентрации инициатора и температуры в радикально-цепных реакциях
- •Оптимизация степени конверсии.
- •7. Важнейшие промышленные химические производства
- •7.1 Проблема фиксации атмосферного азота. Синтез аммиака, Физико-химические основы производства и обоснование выбора параметров и типа реакционного узла. Технологическая схема процесса.
- •Синтез аммиака
- •Сырье для синтеза аммиака.
- •Технология процесса.
- •Основные направления в развитии производства аммиака.
- •7.2. Получение азотной кислоты. Физико-химические основы химических стадий процесса, обоснование выбора параметров и типа реакторов. Технологическая схема процесса.
- •Физико-химические основы процесса.
- •Контактное окисление аммиака.
- •Обоснование роли параметров и их выбор.
- •Окисление оксида азота (II) до диоксида.
- •Абсорбция диоксида азота.
- •Технология процесса.
- •7.3. Производство минеральных удобрений. Классификация минеральных удобрений
- •Классификация минеральных удобрений.
- •7.3.1. Азотные удобрения. Физико-химические основы производства нитрата аммония. Устройство реакционного узла. Теоретические основы процесса и его технологическое оформление
- •Производство нитрата аммония.
- •7.3.2. Производство фосфорной кислоты. Физико-химические основы процесса. Технологическая схема
- •Функциональная схема производства эфк.
- •Сернокислотное разложение апатита.
- •7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
- •Производство простого суперфосфата.
- •Производство двойного суперфосфата
- •Азотнокислое разложение фосфатов. Получение сложных удобрений
- •Обжиг серосодержащего сырья.
- •Обоснование роли параметров и их выбор.
- •Сжигание серы.
- •Окисление диоксида серы.
- •Обоснование роли параметров и их выбор.
- •Технология контактного окисления so2.
- •Абсорбция триоксида серы.
- •Перспективы развития сернокислотных производств.
- •7.5. Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора хлорида натрия.
- •Основные направления применения электрохимических производств
- •Электролиз раствора хлорида натрия
- •Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
- •Электролиз раствора хлорида натрия с ртутным катодом
- •7.6. Промышленный органический синтез
- •Первичная переработка нефти.
- •Каталитический риформинг углеводородов.
- •7.6.2. Производство этилбензола и диэтилбензола. Теоретические основы процесса и обоснование выбора условий процесса. Технология процесса
- •7.6.3. Синтезы на основе оксида углерода. Производство метанола. Теоретические основы процесса.
- •Окисление изопропилбензола (кумола)
- •Технологическая схема получения фенола и ацетона кумольным способом.
- •7.6.5. Биохимические производства. Особенности процессов биотехнологии.
- •7.6.5.1. Производство уксусной кислоты микробиологическим синтезом
- •7.6.5.2. Производство пищевых белков
- •8. Химико-технологические методы защиты окружающей среды
- •8.1. Утилизация и обезвреживание твердых отходов
- •8.2. Утилизация и обезвреживание жидких отходов
- •8.3. Обезвреживание газообразных отходов
7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
Существует ряд методов переработки природных фосфатов в удобрения: механические, термические и методы кислотного разложения.
Одним из методов механической обработки является измельчение фосфатов. Полученная фосфористая мука при использовании в кислых почвах медленно растворяется в почвенных водах и таким образом становится долговременно действующим удобрением.
Фосфорные удобрения могут быть получены термическим разложением фосфатов при температурах 1200 – 1800С. Так получают термофосфаты, обесфторенные фосфаты, плавленые магниевые и термощелочные фосфаты.
Основным методом получения фосфорных удобрений является химическое разложение фосфатного сырья. Так, в результате сернокислотной обработки получают простой суперфосфат и фосфорную кислоту, которую в свою очередь, перерабатывают в двойной суперфосфат, преципитат и сложные удобрения.
Производство простого суперфосфата.
Сущность производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат (Ca(H2PO4)2)
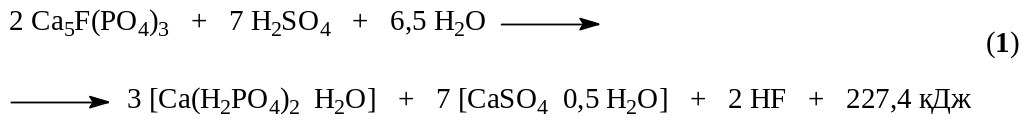
В этом процессе разложение протекает в две стадии. На первой стадии около 70% апатита реагирует с серной кислотой. При этом образуется фосфорная кислота и полугидрат сульфата кальция (уравнение (1)). Эта стадия характеризуется образованием поверхностных пленок CaSO4 на зернах фосфата. Структура образующейся корки обусловлена скоростью кристаллизации твердой фазы, зависящей главным образом от пресыщения раствора сульфатом кальция, которое определяется в свою очередь концентрацией серной кислоты, температурой и другими факторами. Поэтому необходима оптимальная концентрация серной кислоты, сочетающая достаточную скорость растворения апатита с образованием рыхлой пленки, более проницаемой для диффузии серной кислоты к поверхности фосфата. Первая стадия заканчивается через 20 – 40 минут после смешения фосфата с серной кислотой. После полного исчезновения серной кислоты начинается вторая стадия разложения, в которой оставшийся апатит (~ 30%) разлагается фосфорной кислотой
![]()
Образующийся монокальцийфосфат в отличие от сульфата кальция не сразу выпадает в осадок. Он постепенно насыщает раствор фосфорной кислоты, после чего начинает выкристаллизовываться в виде Ca(H2PO4)2H2O и протекает значительно медленнее, чем реакция (1), что объясняется низкой активностью фосфорной кислоты и кристаллизацией твердых фаз. Она начинается в суперфосфатных камерах и длится в течение 5 – 20 суток хранения суперфосфата на складе.
Для получения твердого продукта более высокого качества суперфосфат перед дозреванием подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т.п.) и гранулируют.
Производство двойного суперфосфата
Двойной суперфосфат – концентрированное фосфорное удобрение. Получаемое разложением природных фосфатов фосфорной кислотой. Оно содержит 42 – 50 % усвояемого P2O5, что в 2-3 раза больше, чем в простом суперфосфате. В отличие от последнего двойной суперфосфат почти не содержит балласта – сульфата кальция. Процесс протекает по уравнению (2).
