
- •Содержание
- •1. Введение.
- •1.1 Общие закономерности химических процессов. Классификация процессов общей химико-технологических процессов
- •Требования к химическим производствам
- •Компоненты химического производства
- •Разделение на две твердые фазы:
- •Разделение жидкости и твердого вещества:
- •1.2 Промышленный катализ
- •Основные положения теории катализа.
- •1.3. Сырьевая база химической промышленности.
- •Классификация сырья
- •Характеристика минерального сырья
- •Химическое сырье
- •Растительное и животное сырье
- •Характеристика разработок минерального сырья
- •Качество сырья и методы его обработки
- •Способы сортировки:
- •Способы обогащения:
- •Сырьевая база химических производств
- •1.4 Энергетическая база химических производств
- •1.5 Критерии оценки эффективности производства
- •1.5.1. Интегральные уравнения баланса материальных потоков в технологических процессах. Понятие о расходных коэффициентах. Относительный выход продукта
- •1.5.2. Балансы производства
- •1. Материальный баланс
- •2. Энергетический (тепловой) баланс
- •3. Экономический баланс
- •1.5.3. Технологические параметры химико-технологических процессов.
- •1.6.Принципы создания ресурсосберегающих технологий
- •2. Теоретические основы химической технологии
- •2.1. Энергия в химическом производстве. Тепловой эффект реакции в технологических расчетах. Направленность реакции в технологических расчетах
- •2.2 Массообменные процессы. Основные принципы массообменных процессов. Моделирование процессов теплообмена.
- •Молекулярная диффузия. Первый закон Фика
- •Турбулентная диффузия
- •Уравнение массоотдачи
- •Уравнение массопередачи
- •Связь коэффициента массопередачи и коэффициентов массоотдачи (или уравнение аддитивности фазовых сопротивлений)
- •Подобие массобменных процессов
- •3. Химическое производство как сложная система. Иерархическая организация процессов в химическом производстве
- •3.1. Химико-технологические системы (хтс). Элементы хтс. Структура и описание хтс. Методология исследования хтс, синтез и анализ хтс.
- •Методология исследование химико-технологических систем.
- •3.2. Сырьевая и энергетическая подсистема хтс
- •1. Классификация химических реакторов по гидродинамической обстановке.
- •2. Классификация химических реакторов по условиям теплообмена.
- •3. Классификация химических реакторов по фазовому составу реакционной массы.
- •4. Классификация по способу организации процесса.
- •5. Классификация по характеру изменения параметров процесса во времени.
- •6. Классификация по конструктивным характеристикам.
- •3.4. Промышленные химические реакторы. Реакторы для гомогенных процессов, гетерогенных процессов с твердой фазой, гетерогенно-каталитических процессов, гетерофазных процессов.
- •Реакторы для гетерогенных процессов с твердой фазой.
- •Реакторы для гетерогенно-каталитических процессов.
- •4. Основные математические модели процессов в химических реакторах
- •4.1. Идеальные химические реакторы. Непрерывный реактор идеального вытеснения. Непрерывный реактор идеального смешения
- •4.2. Сравнение эффективности проточных реакторов идеального смешения и идеального вытеснения. Обоснование использования каскада реакторов.
- •Каскад реакторов смешения.
- •Влияние степени конверсии.
- •Влияние температуры.
- •5. Применение кинетических моделей для выбора и оптимизации условий проведения процессов
- •5.1. Экономические критерии оптимизации и их применение для оптимизации реакционных узлов.
- •Оптимальные концентрации инициатора и температуры в радикально-цепных реакциях
- •Оптимизация степени конверсии.
- •7. Важнейшие промышленные химические производства
- •7.1 Проблема фиксации атмосферного азота. Синтез аммиака, Физико-химические основы производства и обоснование выбора параметров и типа реакционного узла. Технологическая схема процесса.
- •Синтез аммиака
- •Сырье для синтеза аммиака.
- •Технология процесса.
- •Основные направления в развитии производства аммиака.
- •7.2. Получение азотной кислоты. Физико-химические основы химических стадий процесса, обоснование выбора параметров и типа реакторов. Технологическая схема процесса.
- •Физико-химические основы процесса.
- •Контактное окисление аммиака.
- •Обоснование роли параметров и их выбор.
- •Окисление оксида азота (II) до диоксида.
- •Абсорбция диоксида азота.
- •Технология процесса.
- •7.3. Производство минеральных удобрений. Классификация минеральных удобрений
- •Классификация минеральных удобрений.
- •7.3.1. Азотные удобрения. Физико-химические основы производства нитрата аммония. Устройство реакционного узла. Теоретические основы процесса и его технологическое оформление
- •Производство нитрата аммония.
- •7.3.2. Производство фосфорной кислоты. Физико-химические основы процесса. Технологическая схема
- •Функциональная схема производства эфк.
- •Сернокислотное разложение апатита.
- •7.3.3. Фосфорные удобрения. Физико-химические основы процессов их производства. Типы реакционных узлов.
- •Производство простого суперфосфата.
- •Производство двойного суперфосфата
- •Азотнокислое разложение фосфатов. Получение сложных удобрений
- •Обжиг серосодержащего сырья.
- •Обоснование роли параметров и их выбор.
- •Сжигание серы.
- •Окисление диоксида серы.
- •Обоснование роли параметров и их выбор.
- •Технология контактного окисления so2.
- •Абсорбция триоксида серы.
- •Перспективы развития сернокислотных производств.
- •7.5. Электрохимические производства. Теоретические основы электролиза водных растворов и расплавленных сред. Технология электролиза раствора хлорида натрия.
- •Основные направления применения электрохимических производств
- •Электролиз раствора хлорида натрия
- •Электролиз раствора NaCl с твердым катодом и фильтрующей диафрагмой
- •Электролиз раствора хлорида натрия с ртутным катодом
- •7.6. Промышленный органический синтез
- •Первичная переработка нефти.
- •Каталитический риформинг углеводородов.
- •7.6.2. Производство этилбензола и диэтилбензола. Теоретические основы процесса и обоснование выбора условий процесса. Технология процесса
- •7.6.3. Синтезы на основе оксида углерода. Производство метанола. Теоретические основы процесса.
- •Окисление изопропилбензола (кумола)
- •Технологическая схема получения фенола и ацетона кумольным способом.
- •7.6.5. Биохимические производства. Особенности процессов биотехнологии.
- •7.6.5.1. Производство уксусной кислоты микробиологическим синтезом
- •7.6.5.2. Производство пищевых белков
- •8. Химико-технологические методы защиты окружающей среды
- •8.1. Утилизация и обезвреживание твердых отходов
- •8.2. Утилизация и обезвреживание жидких отходов
- •8.3. Обезвреживание газообразных отходов
Технология контактного окисления so2.
Чаще всего в промышленности используют полочные аппараты со съемом тепла реакции между полками. Схема теплообменника предполагает максимальное использование тепла реакции для подогрева исходного газа. При этом съем тепла между полками осуществляют в той мере, которая позволяет приближать рабочую температуру к оптимальному значению этого параметра.
Одна из важнейших задач производства серной кислоты состоит в увеличении степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи – метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3; в оставшемся реакционном газе соотношение O2 : SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ опять подают в контактный аппарат, где на достигается 95% степень превращения оставшегося SO2. Суммарная степень превращения SO2 в таком процессе достигает 99,5 – 99,8%.
Абсорбция триоксида серы.
Абсорбция триоксида серы – последняя стадия процесса на которой образуется серная кислота. Взаимодействие SO3 с водой
![]()
протекает достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять в себе SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы серной кислоты чрезвычайно агрессивны.
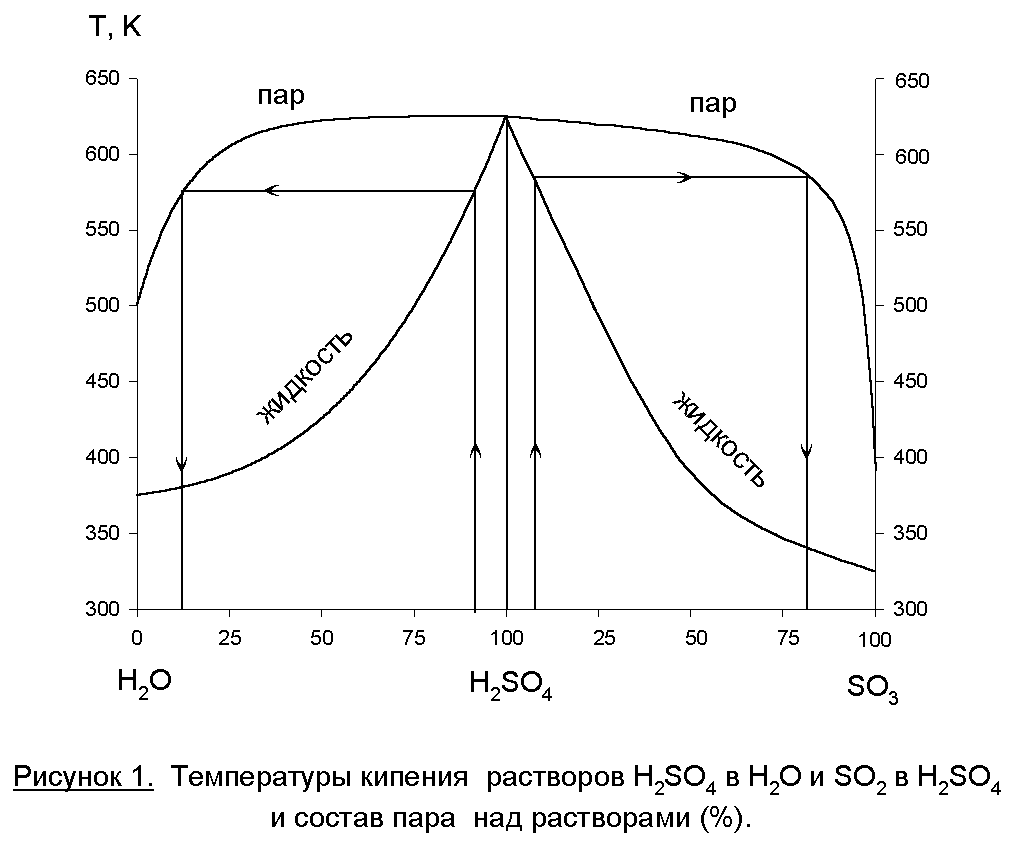
Равновесие «газ-жидкость» для «H2O-H2SO4-SO3» представлено на рисунке 1. Особенностью этой системы является то, что в широком интервале концентраций раствора серной кислоты в паровой фазе присутствуют чистые пары воды, а над олеумом – в газовой фазе преобладает SO3. Одинаковый состав жидкой и паровой фаз (азеотропная точка) будет при концентрации серной кислоты 98,3%. Если SO3 поглощать раствором с меньшей концентрацией, то реакция (3) будет протекать и в паровой фазе – будет образовываться туман серной кислоты, который уйдет из абсорбера с газовой фазой. А это – и потери продукта, и коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсорбировать олеумом, то поглощение будет неполным.
Из этих двух свойств следует двухстадийная
схема абсорбции (рисунок 2). Газ, содержащий
SO3 после реактора проходит
последовательно олеумый (1) и
моногидратный (2) абсорберы. Другой
компонент реакции (H2O)
подается противотоком через сборник в
моногидратный абсорбер. За счет
интенсивной циркуляции жидкости
(абсорбата) в ней можно поддерживать
близкую к оптимальной концентрацию
H2SO4
– 98,3% (увеличение к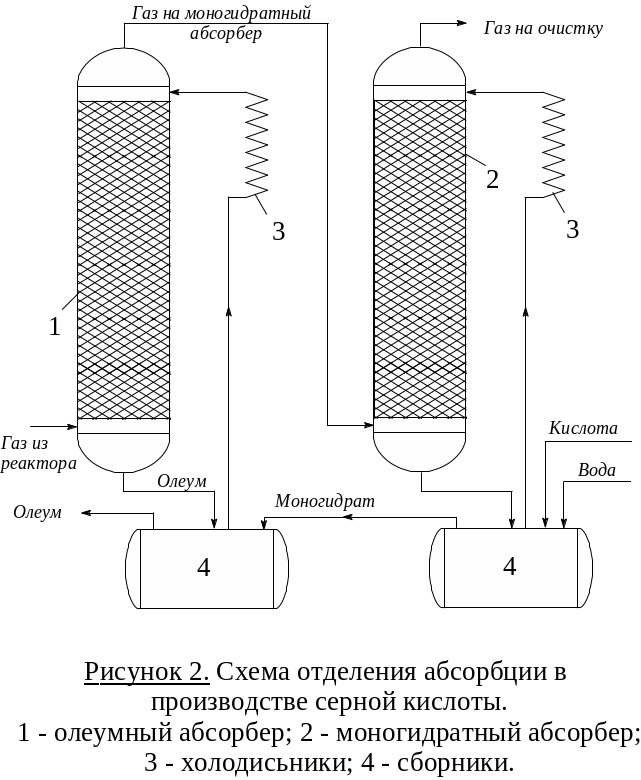 онцентрации
за проход жидкости не более 1 – 1,5%).
Концентрационные условия абсорбции
обеспечиваю полное поглощение SO3
и минимальное образование сернокислого
тумана. Кислота из моногидратного
абсорбера поступает в олеумный. В нем
циркулирует 20% раствор Н2SO4,
который частично отбирается как конечный
продукт – олеум. Кислота из предыдущего
абсорбера – моногидрат – также может
быть продуктом. В системе циркуляции
предусмотрены холодильники для съема
тепла реакции и обеспечения более
эффективной абсорбции. При температурах
меньше 100С SO3
поглощается практически полностью,
диоксид серы – практически не поглощается.
онцентрации
за проход жидкости не более 1 – 1,5%).
Концентрационные условия абсорбции
обеспечиваю полное поглощение SO3
и минимальное образование сернокислого
тумана. Кислота из моногидратного
абсорбера поступает в олеумный. В нем
циркулирует 20% раствор Н2SO4,
который частично отбирается как конечный
продукт – олеум. Кислота из предыдущего
абсорбера – моногидрат – также может
быть продуктом. В системе циркуляции
предусмотрены холодильники для съема
тепла реакции и обеспечения более
эффективной абсорбции. При температурах
меньше 100С SO3
поглощается практически полностью,
диоксид серы – практически не поглощается.
