- •Введение
- •1. Коррозия обектов магистрального трубопроводного транспорта нефти и газа
- •1.1. Коррозионные процессы и продукты коррозии
- •1.2. Классификация процессов коррозия
- •1.3. Виды коррозионных разрушений
- •1.4. Способы выражения скорости коррозии
- •1.5. Способы защиты стальных сооружений от коррозии
- •Контрольные вопросы
- •2. Химическая коррозия стальных сооружений
- •2.1. Термодинамическая возможность химической коррозии
- •2.2. Механизм химической коррозии
- •2.3. Влияние окисных пленок на процесс коррозии
- •2.4. Законы роста пленок на поверхности стальных сооружений
- •2.4.1. Закон роста несплошных пленок
- •2.4.2. Закон роста сплошных пленок
- •2.4.3. Закон роста пленок при одинаковых скоростях диффузии окислителя коррозионной среды и ионов металла
- •Контрольные вопросы
- •3. Электрохимическая коррозия стальных сооружений
- •3.1. Термодинамическая возможность электрохимической коррозии металлов
- •3.2. Электродные потенциалы металлов в электролитах
- •3.3. Кинетика электрохимической коррозии металлов
- •3.4. Механизм катодной поляризации
- •3.5. Атмосферная коррозия стальных сооружений
- •3.6. Коррозия стальных трубопроводов в болотной и речной воде
- •Результаты химического анализа почвенного электролита грунтов нефтегазодобывающих регионов
- •3.8. Подземная коррозия стальных сооружений
- •3.9. Микробиологическая коррозия стальных подземных сооружений
- •3.10. Коррозия подземных стальных сооружений блуждающими токами
- •Контрольные вопросы
- •4. Коррозионные изыскания
- •4.1. Методы определения коррозинной активности грунтов
- •Сопоставление коррозионного состояния действующих нефтегазопроводов Западной Сибири с удельным электрическим сопротивлением грунта и плотностью предельного тока кислорода
- •Полевой метод определения удельного электрического сопротивления грунта
- •Полевой метод определения предельного тока по кислороду в толще грунта
- •Лабораторно-полевой метод определения коррозионной активности грунтов по поляризационным кривым и по потере массы стальных образцов
- •4.2. Определение опасности коррозии, вызываемой блуждающими токами, при помощи электрических измерений
- •Определение величины поляризационного потенциала подземных стальных сооружений
- •Определение качества изоляции подземного стального трубопровода методом катодной поляризации
- •Контрольные вопросы
- •5. Изоляционные покрытия
- •5.1. Назначение изоляционных покрытий
- •5.2. Требования к изоляционным покрытиям.
- •5.3. Мастичные покрытия.
- •5.4. Полимерные покрытие
- •5.5. Комбинированные покрытия
- •5.6. Прочие виды изоляционных покрытий
- •Покрытия из эмали и стеклоэмали
- •Покрытия из напыленного или экструдированного полиэтилена
- •5.7. Пооперационный контроль качества изоляционных работ
- •Приборы для контроля изоляционных покрытий
- •Техническая характеристика адгезиметров
- •Техническая характеристика искателя повреждений ип-95
- •Техническая характеристика искрового дефектоскопа идм-1м
- •Техническая характеристика искровых дефектоскопов
- •Контрольные вопросы
- •6. Подготовка поверхности металла перед нанесением защитных покрытий
- •Состояние поверхности металла
- •Способы подготовки поверхности
- •6.1. Механическая очистка Очистка с помощью инструментов
- •Струйная очистка
- •6.2. Термическая очистка
- •6.3. Химическая очистка Обезжиривание
- •Травление
- •6.4. Полирование
- •Степени чистоты поверхности стали
- •Контрольные вопросы
- •7. Противокоррозионная защита полости рвс
- •Л итература
- •Содержание
- •Противокоррозионная защита объектов трубопроводного транспорта нефти и газа
3.3. Кинетика электрохимической коррозии металлов
Причиной электрохимической коррозии металлов является их термодинамическая неустойчивость - самопроизвольное растворение при взаимодействии с электролитами, образование двойного электрического слоя на границе раздела фаз и переход металла в устойчивое окисленное состояние. Электрохимическая реакция протекает с образованием свободных электронов по схеме (окислительный или анодный процесс):
Me
+ mH2O
![]() Men+
+ mH2O
+ ne,
Men+
+ mH2O
+ ne,
где n - число атомов металла в молекуле окисла; или по схеме восстановительного процесса:
Меn+ + mH2O + ne = Me + mH2O.
Эти две реакции протекают одновременно на одной и тоже корродирующей поверхности или в разных местах и разновременно. Разделение процесса растворения металла в электролитах на два сопряженных процесса — анодный и катодный — облегчает в большинстве случаев его протекание по сравнению с химическим взаимодействием. При электрохимическом взаимодействии металла с содержащимся в электролите окислителем, например, молекулярным кислородом, последний играет лишь роль деполяризатора, отнимающего валентные электроны металла и обеспечивающего переход металла в ионное состояние, но не вступает с ним в химическое соединение. Для протекания непрерывного процесса электрохимической коррозии необходимо соединить анодные и катодные участки проводником электрического тока, обеспечивающим передачу свободных электронов с анода на катод. В результате образуется гальванический элемент (рис. 3.3.1), состоящий из короткозамкнутых электродов – анода, где ионы железа стального сооружения покидают кристаллическую решетку и переходят в электролит: Fe – 2e = Fe2+ и катода, где окислительные компоненты электролита (нейтральные молекулы растворенного кислорода или ионы водорода) забирают из кристаллической решетки оставленные ионами железа электроны и восстанавливаются:
O2 + 4e + 2H2O = 4OH- (реакция кислородной деполяризации);
2H+ + 2e = H2 (реакция водородной деполяризации).
В представленной на рис. 3.3.1 схеме положительным полюсом является катод, где происходит электровосстановление молекул водорода или ионов водорода, отрицательным – анод, где ионы железа под действием сил гидратации покидают кристаллическую решетку. Например, при электрохимической защите подземных или подводных стальных сооружений, когда электрохимические реакции окисления и электровосстановления протекают под действием приложенного извне постоянного тока, катодом, наоборот, считается отрицательный полюс, а анодом – положительный.
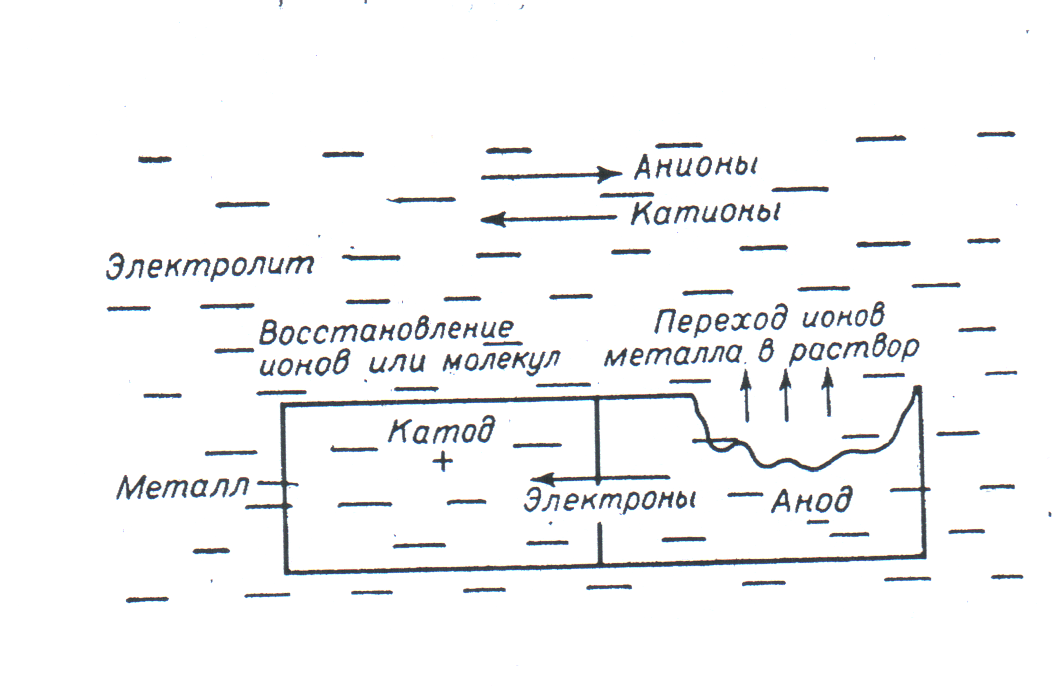
Рис. 3.3.1. Схема протекания электрохимической коррозии на поверхности стального сооружения
Представленная на рис. 3.3.1 схема протекания электрохимической коррозии применительно к магистральным и технологическим нефтегазопроводам реализуется по схеме, представленной на рис. 3.3.2.
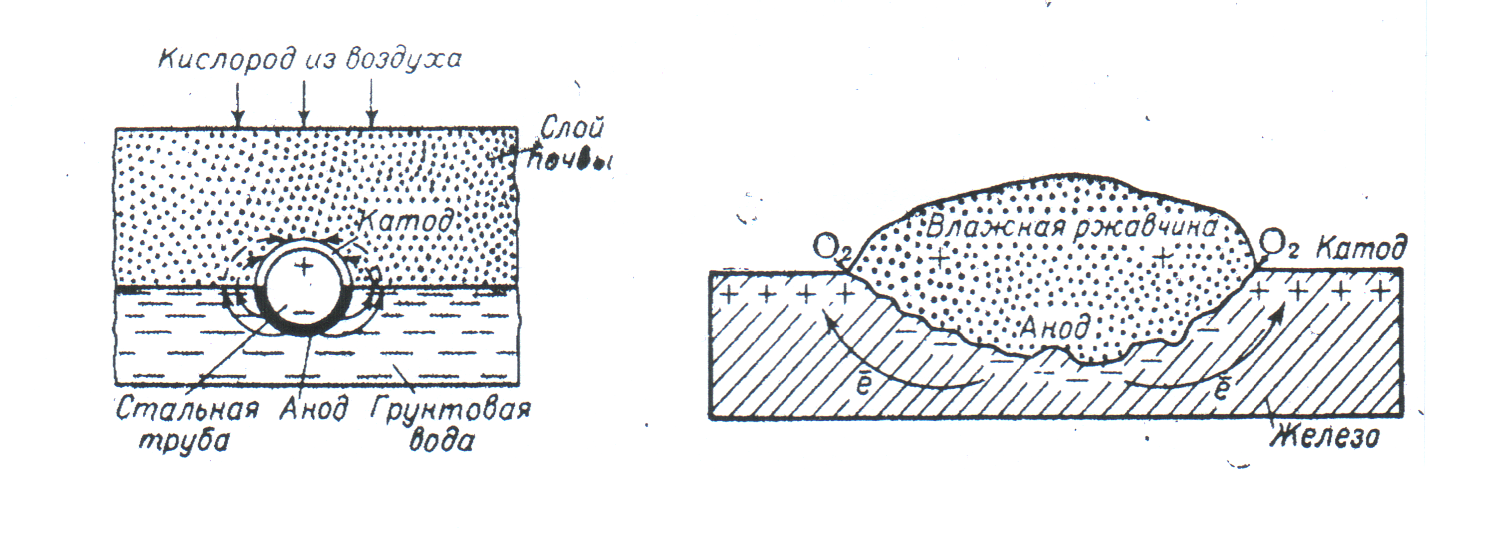
Рис. 3.3.2. Коррозионные гальванические элементы, вызванные различной аэрацией поверхности подземного стального трубопровода
Электродами гальванического элемента называются металлы или их сплавы, погруженные в электролит и имеющие проводник для отвода тока (свободных электронов). Электроды или сами являются активными веществами, или находятся с ними в непосредственном контакте.
Активными называются вещества, в результате превращения которых в процессе реакции высвобождается электрическая энергия. Обычно активным веществом гальванического элемента является отрицательно заряженный электрод - анод, на котором идет реакция окисления. На положительно заряженном электроде - катоде идет реакция восстановления. Например, при работе химического источника тока, отрицательно заряженные частицы (анионы) перемещаются к аноду, а положительно заряженные, ионы (катионы) движутся к катоду. Количественное соотношение между химическим превращением вещества на электродах и электрической энергией определяется законами Фарадея.
Первый закон Фарадея: масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества, пропущенного через электролит.
Второй закон Фарадея: отношение масс веществ, претерпевающих превращения на электродах при пропускании через раствор одинаковых электрических зарядов, равно отношению химических эквивалентов этих веществ.
Химическим эквивалентом называется - безразмерная величина, равная отношению массы элемента к массе соединяющегося с ним водорода или вещества, заменяющего водород в соединениях, (кислород и др.).
Согласно второму закону Фарадея установлено, что при пропускании через электролит заряда 96500 Кл (F = 96426,7 ± 0,54 Кл/моль) на аноде окисляется 1 моль одновалентного вещества.
Электрохимическим эквивалентом вещества q(r/Кл) называется количество вещества m(г), окисляющегося на аноде при прохождении через электролит 1 Кл электричества:
![]() .
(3.3.1)
.
(3.3.1)
Тогда количество вещества (М), выделяющегося при прохождении тока силой (I) за время (t), можно определить по формуле:
![]() .
(3.3.2)
.
(3.3.2)
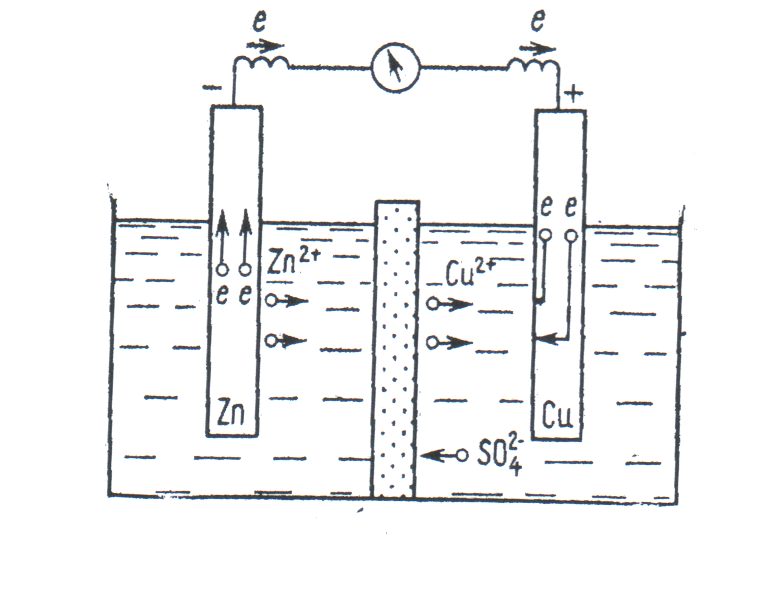
Одна из важнейших характеристик гальванического элемента - его электродвижущая сила: Е = Еок – ЕМе, где Еок, ЕMe - потенциалы катода и анода. Например, для элемента, составленного из медного и цинкового электродов, погруженных в нормальные растворы собственных ионов (см. рис. 3.3.3), пользуясь электрохимическим рядом напряжений (табл. 3.2.1), определим Е = ЕCu – ЕZn = + 0,337 - (-0,763) = 1,1 В. Полученное значение совпадает с измеренным для соответствующего гальванического элемента, представленного на рис. 3.3.3.
Для большинства металлов в реальных условиях электрохимическая коррозия протекает по гетерогенно-электрохимическому механизму, т.е. через локальные элементы. Разные точки поверхности металлов различаются энергией и свойствами, что отражается на кинетике электрохимической реакции. Особенно много таких зон возникает, когда координирующая поверхность стального сооружения неоднородна по структуре, имеет искажения в кристаллической решетке, содержит посторонние включения. В случаях, когда координирующая поверхность стального сооружения при этом покрыта электролитом с высокой электропроводностью, на этих неоднородностях появляются местные гальванопары, теория которых детально разработана в нашей стране А.К. Фрумкиным, Г.В. Акимовым, Н.Д. Томашовым, Ю.Н. Михайловским и др.
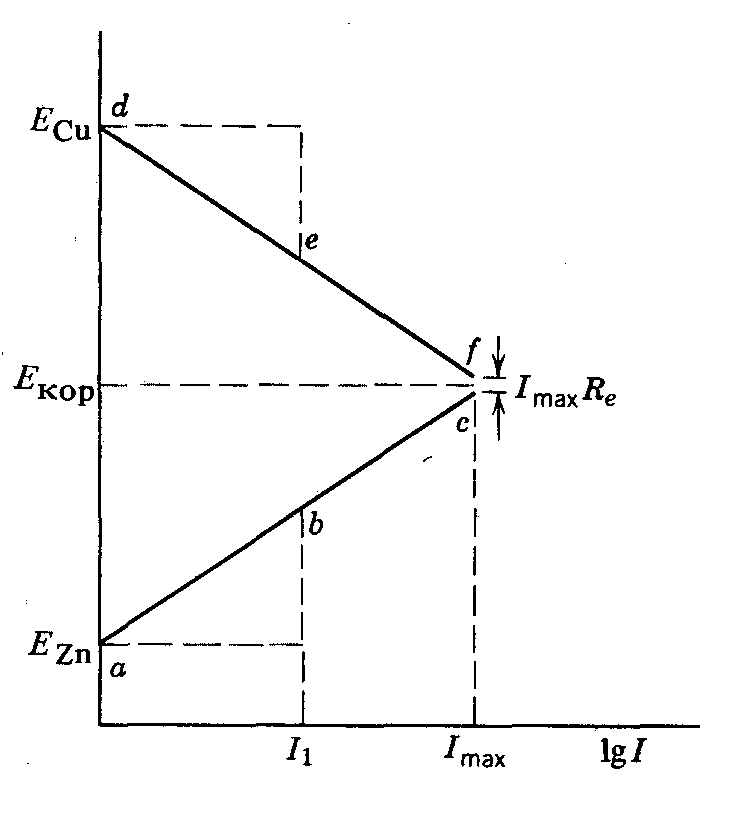
Влияние силы тока в цепи медно-цинкового коррозионного элемента можно графически изобразить с помощью поляризационных кривых, представляющих собой зависимость потенциалов Е медного и цинкового электродов от величины коррозионного тока. См. рис. 3.3.4, где ЕZn и ЕCu собственные потенциалы цинкового и медного электродов до их закорачивания. После закорачивания электродов и появления в цепи коррозионного тока, поляризация цинкового электрода характеризуется кривой abc, а медного – def. При значении коррозионного тока, равном I1, поляризация цинка в вольтах определяется как разность между измеренным потенциалом цинка в точке b и потенциалом разомкнутого элемента в точке ЕZn.
|
|
Рис. 3.3.3. Cхема медно-цинкового коррозионного элемента (элемент Даниэля) |
Рис. 3.3.4. Поляризационные кривые медно-цинкового коррозионного элемента |
Подобным образом,
поляризация меди равна разности
потенциалов в точках ЕCu
и e.
Разность потенциалов поляризованных
электродов
![]() равна току I1,
умноженному на общее сопротивление:
равна току I1,
умноженному на общее сопротивление:
![]() ,
то есть на сумму внешнего сопротивления
замкнутых металлов RMe
и внутреннего сопротивления электролитов
RЭл,
соединенных последовательно:
,
то есть на сумму внешнего сопротивления
замкнутых металлов RMe
и внутреннего сопротивления электролитов
RЭл,
соединенных последовательно:
![]()
При
коротком замыкании цинкового и медного
электродов величина тока коррозии
достигает максимального значения Imax,
тогда величиной RMe
можно
пренебречь, и разность потенциалов
обоих электродов снижается до минимума:
ImaxRe.
Максимальный ток определяет количество
цинка в граммах, корродирующего в
секунду, как:![]() ,
где Imax
– максимальный коррозионный ток; F
– число
Фарадея, равное 96500 Кл-экв; 65,38/2 –
эквивалентная масса цинка.
,
где Imax
– максимальный коррозионный ток; F
– число
Фарадея, равное 96500 Кл-экв; 65,38/2 –
эквивалентная масса цинка.
Соответственно,
катодная реакция обусловливает осаждение
на катоде эквивалентного количества
меди. Скорость коррозии цинка может
возрасти, если снизить поляризацию
цинка или меди или того и другого
одновременно, уменьшая тем самым наклоны
кривых abc
и def,
что в свою очередь сместит точку их
пересечения в сторону увеличения
коррозионного тока. Таким образом, любой
фактор, способствующий увеличению
поляризации, будет вызывать уменьшение
коррозионного тока, соответственно,
уменьшение поляризации приводит к
увеличению коррозионного тока. Измеряемый
потенциал корродирующего элемента –
это некоторый компромиссный потенциал
поляризованных анодов и катодов,
называемый потенциалом коррозии Екор.
Согласно закону Фарадея, скорость
коррозии анода ja
пропорциональна Iкор,
следовательно, скорость коррозии на
единицу площади поверхности металла
всегда можно выразить через плотность
тока. Однако в том случае, когда интересует
только общая величина коррозии, а не
распределение ее по поверхности, всю
корродирующую поверхность условно
можно принять однородной. При этом
следует иметь в виду, что при такой
замене средняя скорость коррозии не
определяет опасность коррозионного
разрушений стального сооружения (может
иметь место местная питтинговая
коррозия). При этом скорость коррозии
характеризуется анодной плотностью
тока:
![]() ,
где Sa
- площадь анода. Причины появления
неоднородности металлов - макро- и
микровключения, неоднородность сплава
(наличие сварных швов), разнородность
металлов, нарушение изоляционного
покрытия, наличие на металле окалины,
ржавчины, неравномерная деформация,
неравномерность приложенных нагрузок
и др.
,
где Sa
- площадь анода. Причины появления
неоднородности металлов - макро- и
микровключения, неоднородность сплава
(наличие сварных швов), разнородность
металлов, нарушение изоляционного
покрытия, наличие на металле окалины,
ржавчины, неравномерная деформация,
неравномерность приложенных нагрузок
и др.
Таким образом, особенности электрохимического коррозионного разрушения стальных сооружений состоят в следующем:
- разделение общего коррозионного процесса на два сопряженных - анодного и катодного;
- зависимость скорости коррозии от значения электродного потенциала металла - смещение его в положительную сторону (поляризация от внешнего источника тока) облегчает анодный процесс и затрудняет катодный, а смещение в отрицательную сторону ускоряет катодный процесс и тормозит анодный;
- возможность локализации коррозионного процесса на отдельном участке поверхности корродирующего металла;
- разрушение (растворение) стальных сооружений на анодных участках корродирующей поверхности.