
- •Современное лечение сахарного диабета 2 типа и его перспективы
- •Введение
- •Классификация и диагностика сахарного диабета
- •Классификация сахарного диабета
- •3. Необычные формы иммунноопосредованного диабета (синдром обездвиженности; антитела к рецепторам инсулина, антитела к инсулину и др.)
- •Гестационный сахарный диабет
- •Диагностика и клиническая картина
- •Лечение сахарного диабета типа 2
- •Общие требования к диете:
- •5,68±0,82 Ммоль/л; триглицериды - 1,68±0,71 ммоль/л; холестерин липопротеидов высокой плотности - 1,42 ммоль/л; холестерин липопротеидов низкой плотности - 3,6±0,75 ммоль/л.
- •20ХИри(мкЕд/мл)
- •Лечение сахарного диабета типа 2
- •84 Мин, глибутид, адебит, силубин). В 1953-57г были апробированы и предложены для клинического применения фенформин, буформин и метформин. В настоящее
- •2) Прием пероральных сахароснижающих средств сохраняется и дополнительно к ним назначается
- •Перспективы терапии сахарного диабета типа 2 |
- •I j.F.P. Luiken и соавт. (2003) показали, что оба соединения стимулируют амрк кар-диоцитов и увеличивают поглощение жирных кислот находящимися в покое (не-
84 Мин, глибутид, адебит, силубин). В 1953-57г были апробированы и предложены для клинического применения фенформин, буформин и метформин. В настоящее
Бигуаниды не изменяют секрецию инсулина и не оказывают биологического сахароснижающего эффекта при его отсутствии. В присутствии инсулина они увеличивают периферическую утилизацию глюкозы, уменьшают глюконеогенез, повышают утилизацию глюкозы кишечником, что проявляется снижением уровня глюкозы в крови, оттекающей от кишечника; а также снижают повышенное содержание инсулина в сыворотке крови у больных, страдающих ожирением и сахарным диабетом типа 2. С учетом указанного механизма действия метформина правильнее говорить не о его гипогликемическом, а о антигипергликемическом влиянии.
Печень является основным органом, в котором происходят образование глюкозы и клиренс лактата. Натощак пируват и лактат утилизируются в процессе глюконеогенеза путем повышения активности митохондриальной пируват-карбоксилазы. Основным путем удаления лактата после приема пищи является окисление пирувата в ацетил-СоА. Эта реакция контролируется активностью митохондриального пируватдегидрогеназного комплекса.
Положительное влияние бигуанидов на углеводный обмен одновременно сопровождается изменениями обмена липидов, которое заключается в уменьшении абсорбции жира из желудочно-кишечного тракта и циркулирующих липидов в плазме крови. Бигуаниды снижают отложение жира в печени, способствуя при этом накоплению гликогена и препятствуя его распаду и выходу в кровь. В исследованиях на животных доказано, что метформин угнетает Поглощение изотопа холестерина в тканях аорты кроликов, что одновременно сопровождается снижением биосинтеза липидов в печени и аорте (G. Marque, 1978). Метформин не только угнетает развитие атеросклероза, но и способствует регрессу атеросклероза аорты (G Marque, 1983). Если под влиянием фенформина практически не изменялось содержание липидов в плазме крови и отсутствовали атеросклеротические изменения в аорте, то под влиянием метформина при отсутствии изменений в концентрации липидов в плазме крови, четко проявлялось протективное влияние метформина на сосудистую стенку артерий и развитие атеросклероза (J.Sterne и J.Junien,1981).
Бигуаниды оказывают, по данным лишь некоторых авторов, незначительное аноректическое действие. Длительное их применение положительно влияет на липидный обмен (снижение уровня холестерина, триглицеридов). Бигуаниды увеличивают количество ГЛЮТ-4, что проявляется в улучшении транспорта глюкозы через мембрану клетки. Именно этим эффектом объясняется потенцирующее их влияние на действие инсулина. Местом действия бигуанидов, вероятно, является митохондриальная мембрана. Угнетая глюконеогенез, бигуаниды способствуют увеличению содержания лактата, пирувата, аланина, т.е. веществ, являющихся предшественниками глюкозы в процессе глюконеогенеза. Ввиду того, что при действии бигуанидов количество увеличивающегося лактата превышает образование пирувата, это может являться основой для развития молочнокислого ацидоза (лактатацидоз).
Печень, как отмечалось ранее, является основным органом, в котором происходит образование глюкозы и клиренс лактата, что контролируется активностью митохондриального пируватдегидрогеназного комплекса.
Фенформин угнетает поглощение и окисление лактата в печени, а также усиливает внепеченочное образование лактата. Эти действия фенформина объясняется его способностью связываться с митохондриальной мембраной, приводя к ухудшению транспорта редуцирующих веществ, таких как NADH. Последнее в свою очередь приводит к угнетению двух основных путей распределения лактата, т.е. к снижению его окисления и использования в глюконеогенезе.
В противоположность фенформину, метформин экскретируется почками в неизмененном виде и не подвергается никакой биотрансформации и не инактивиру-ется в печеночной ткани. Хотя метформин уменьшает продукцию глюкозы печенью, но большинство исследователей считают, что этот эффект не является следствием взаимодействия и нарушением метформином функции митохондриальной мембраны и не сочетается с угнетением окислительной функции митохондрий. \
Именно поэтому судьба трех препаратов из группы бигуанидов оказалась неоди- \ наковой. Фенформин оказывает наиболее выраженное сахароснижающее дейс- j твие и поэтому его более широко, по сравнению с другими бигуанидами, применяли | для лечения сахарного диабета типа 2. К 1974-75г было опубликовано достаточное ] количество наблюдений о развитии лактатацидоза у более чем 350 больных, получавших лечение бигуанидами. На основании данных свидетельствующих о высоком сочетании лактатацидоза с приемом фенформина, FDA (Комиссия по контролю лекарств и пищевых продуктов США) с 1976г. запретила использование бигуанидов в клинической практике. Аналогичное решение было принято и в Канаде.
Однако, при тщательном анализе опубликованных данных оказалось, что наиболее часто лактат-ацидоз встречался при применении фенформина, поэтому последний с 1978 г. не используется для лечения сахарного диабета практически во всех странах мира, включая и нашу страну. По этой же причине и в связи с низкой сахароснижающей активностью практически во всех странах мира не применяется буформин (адебит, силубин).
Метформин в настоящее время является основным и единственным препаратом из группы бигуанидов, применяемых для лечения сахарного диабета типа 2. Его значимость в терапии диабета была пересмотрена лишь в последнее время благодаря интенсивным экспериментальным и клиническим фармакологическим исследованиям, которые показали роль метформина в нормализации гликемии и инсулиновой резистентности при сахарном диабете типа 2 (N. Wiernsperger,1999).
Сахароснижающее действие метформина (глюкофаж, сиофор, формин) обусловлено несколькими механизмами:
а) уменьшением скорости образования глюкозы печенью за счет снижения глюконеогенеза путем ингибирования окисления липидов;
б) повышением утилизации глюкозы на периферии через активирование пострецепторных механизмов действия инсулина, в частности тирозинки- ' назы, фосфотирозинфосфатазы, и активности глюкозных транспортеров - ГЛЮТ-1, ГЛЮТ-3 и ГЛЮТ-4;
в) повышением утилизации глюкозы слизистой оболочкой кишечника;
г) повышением транспорта глюкозы в эндотелии, гладких мышцах сосудов и в мышце сердца.
Кроме того, метформин оказывает умеренное влияние на снижение содержания липидов в сыворотке крови (холестерина, триглицеридов, холестерина ЛНП и ЛОНП, а также, возможно, повышает уровень холестерина ЛВП), уменьшает инсулинорезистентность, что проявляется снижением уровня инсулина в крови. Терапия метформином сопровождается умеренным снижением массы за счет уменьшения количества жировой ткани. Отмечено положительное влияние на состояние сердечно-сосудистой системы: повышение фибринолиза, снижение уровня ингибитора 1типа активатора плазминогена, пролиферации гладких мышечных клеток в сосудистой стенке in vitro и скорости атерогенеза у животных.
В России, как и во всех странах мира из группы бигуанидов применяется только метформин (глюкофаж, сиофор, формин, глиформин). Период полураспада сио-фора составляет 1,5-3 ч. Препарат выпускается в таблетках по 0,5 и 0,85г (500 и 850 мг). Помимо этого, глюкофаж представлен тремя лекарственными формами: таблетки по 500, 850 и 1000 мг. Терапевтические дозы 1 -2 г в сутки (максимум до 2,55 и реже - до Зг в день). Глюкофаж, также как и другие препараты метформина, следует принимать во второй половине приема пищи или сразу после еды.
Проведенное в России исследование по изучению эффективности и безопасности применения глюкофажа, в котором участвовало 1500 больных сахарным диабетом типа 2, показало высокую эффективность и безопасность применения препарата.
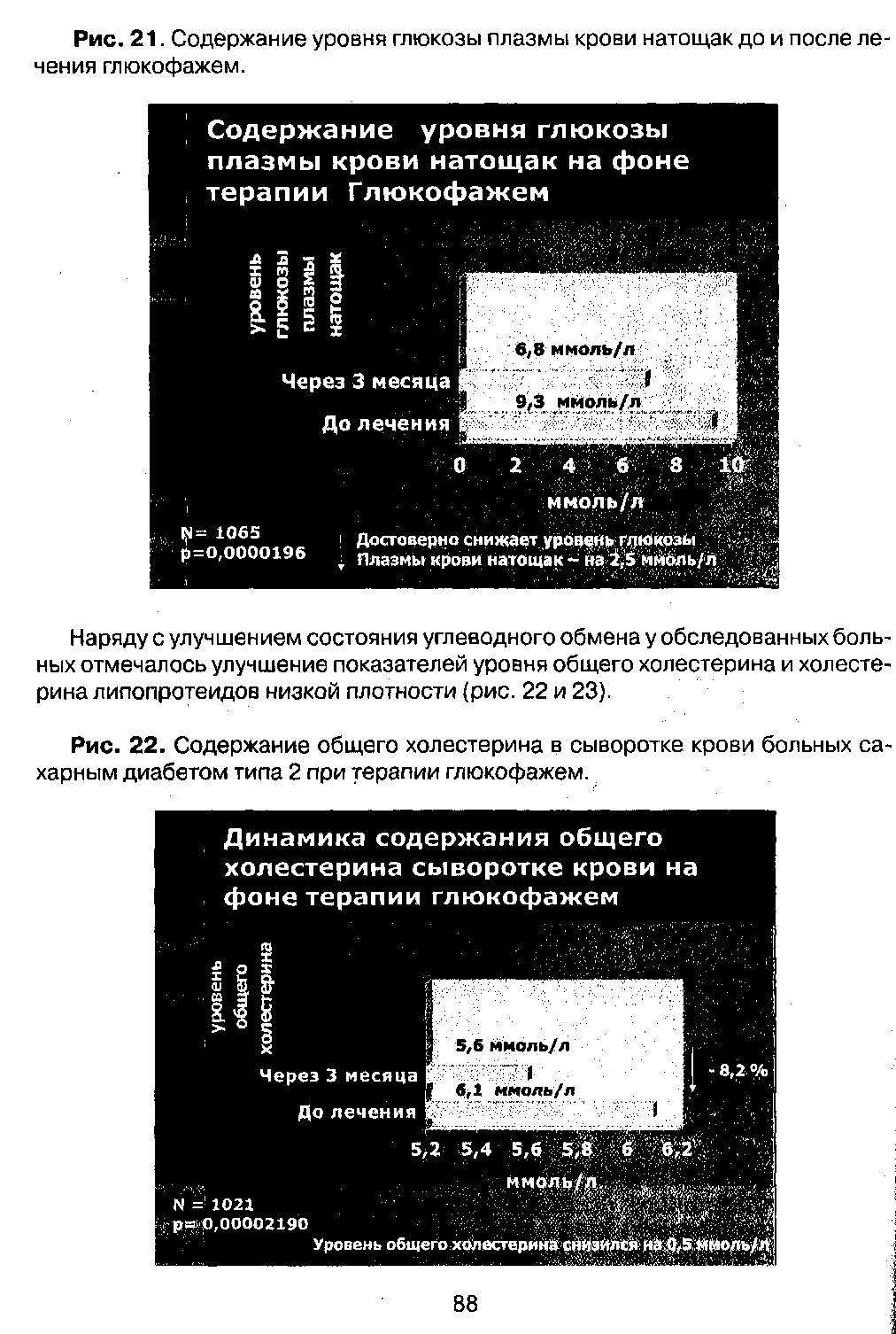
Терапия больных сахарным диабетом типа 2 глюкофажем в течение 3-х месяцев сопровождалась снижением уровня НЬА1с крови на 1,4%2, что представлено на рис. 20.

Наряду со снижением уровня НЬА1с у обследованных больных отмечалось также статистически достоверное снижение уровня глюкозы натощак (рис. 21)

Анализ частоты побочных явлений у больных сахарным диабетом типа 2, возникших при проведении терапии глюкофажем показывает, что наиболее частым нежелательным явлением является нарушение функции желудочно-кишечного тракта, проявляющееся в виде умеренной диспепсии (рис. 25).
 Данные,
представленные на рис. 25 и 26 свидетельствуют
о том, что применение метформина не
сопровождается с побочными явлениями,
представляющими угрозу для состояния
здоровья больных. Полученные данные
совпадают с исследованиями А. J.
Garber
и соавт. (1997), которые были получены при
изучении эффективности метформина
двойным слепым плацебо контролируемым
методом (табл 27).
Данные,
представленные на рис. 25 и 26 свидетельствуют
о том, что применение метформина не
сопровождается с побочными явлениями,
представляющими угрозу для состояния
здоровья больных. Полученные данные
совпадают с исследованиями А. J.
Garber
и соавт. (1997), которые были получены при
изучении эффективности метформина
двойным слепым плацебо контролируемым
методом (табл 27).

Обычно больные хорошо переносят прием метформина. Однако, как уже отмечалось, у некоторых больных отмечаются побочные явления. Наиболее частыми нежелательными явлениями являются нарушения со сторона желудочно-кишечного тракта, которые проявлялись в виде тошноты, рвоты и диспептических явлений. Как показал анализ результатов лечения метформином, проведенный нами, указанные побочные явления носят транзиторный характер и их наличие обусловлено неправильным назначением препарата, т.е. метформин назначался с высоких, а иногда с максимально допустимых доз. Для уменьшения частоты указанных побочных явлений необходимо начинать прием препарата с минимальной дозы (500 мг/ сут) и далее проводить титрацию или увеличение последующей дозы каждые 3-4 дня до достижения максимального эффекта, для получения которого необходимы суточные дозы препарата от 500 до 2500 и лишь иногда до 3000 мг в день в зависимости от степени выраженности нарушения углеводного обмена.
Одним из серьезных и угрожающих жизни побочных явлений, наблюдаемых на фоне терапии метформином является лактат-ацидоз, который встречается у больных, имеющих противопоказания к применению препарата, частота которого представлена в табл 28

Противопоказания к применению метформина перечислены в табл 29.
Таблица 29. Противопоказания к назначению терапии метформином.
1. Нарушение функции почек: повышение содержания креатинина в крови >160 мкг у мужчин и >140 у женщин;
2. Выраженные нарушения функции печени;
3. Клинически выраженные проявления острых и хронических заболеваний, протекающие с гипоксией (острая сердечная и легочная недостаточность, ин- фаркт миокарда);
Применение контрастных веществ;
Серьезные хирургические операции;
Наличие лактатацидоза в анамнезе;
Хронический алкоголизм
Как уже отмечалось выше, глюкофаж помимо антигипергликемического действия оказывает дополнительные положительные влияния: на фоне его приема отсутствует прибавка в весе или чаще на фоне терапии отмечается снижение массы тела; улучшаются показатели липидного обмена особенно уровень триглицеридов, свободных жирных кислот и постпрандиальная гиперлипимия, которые являются факторами риска развития сердечно-сосудистой патологии.
Известно, что сахарный диабет сопровождается кардиомиопатией, которая характеризуется нарушением систолической и диастолической функцией миокарда. Наиболее ранние и выраженные изменения имеются со стороны диастолической функции миокарда. Причем эти изменения не зависят от состояния и функции сосудов сердца. В исследованиях на животных показано, что нарушение возбудительной и сократительной функции сердца сопровождаются изменениями в Са2+ чувствительных миофиламентах и ухудшении функции Са2+ -регулирующих белков (сарколемальная и саркоплазматическая ретикулярная Са2+-АТФаза, натрий/кальциевый белковый обменник).
Сравнительно часто при сахарном диабетеотмечаетсяповышение артериального давления, а на терапии метформином у больных сахарным диабетом достоверно снижается артериальное давление (P. Sundaresan и соавт.,1997), которое является независимым фактором риска развития сосудистых осложнений. Несколько раньше этот эффект метформина был четко продемонстрирован на модели крыс с гипе-ринсулинемией и гипертензией (S.Verma и соавт., 1994). Метформин улучшает все показатели функции сердца при исследованиях, выполненных на изолированном сердце стрептозотоцин-диабетических крыс (S. Verma и J Н McNeill, 1994). Изучая механизм такого влияния на сердечную мышцу, J. Ran и соавт.(1999) показали, что метформин оказывает защитное (протективное) влияние высокой гипергликемии на изменения функции сердечных миоцитов взрослых крыс. В отсутствии метформина или при наличии в инкубационной среде глибурида (сульфонилмочевинный препарат типа глибенкламида) развиваются такие нарушения функции и изменения в миоцитах, которые постоянно встречаются у диабетических животных. Эти изменения, главным образом, в нарушении релаксации миоцитов развиваются как следствие изменения активности тирозинкиназы и связанных с этим изменений в содержании внутриклеточного кальция. В других исследованиях убедительно показано, что метформин модулирует активность тирозинкиназы посредством влияния на образование инозитол 1,4,5-трифосфата (L J Dominguez И соавт., 1996; В J Stith и соавт., 1996). Разработанная указанными авторами модель «диабетического сердца» позволяет изучать только изменения, возникающие при наличии гипергликемии, полностью исключая при этом возможное воздействие других факторов (ги-перлипидемия, гипер- или гипоинсулинемия, гипотироз и др.), которые влияют на угнетение функции миокарда и влияние которых имеют место при проведении исследований in vivo. Модифицируя внутриклеточный гомеостаз кальция, метформин оказывает протективное влияние на миоциты желудочков сердца. У сульфонилмо-чевинного препарата - глибурида (глибенкламида) такой эффект отсутствует.
В последние годы установлено, что под влиянием метформина повышается фиб-ринолиз, который снижен у больных сахарным диабетом типа 2 и который является дополнительным фактором тромбообразования и сосудистых осложнений диабета. Несмотря на то, что фибринолиз является достаточно сложным биохимическим процессом, наиболее важная роль отводится плазмину, неактивным предшественником которого является плазминоген. Под влиянием активатора плазминогена тканевого и урокиназного типа плазминоген конвертируется в плазмин, растворяя фиксированный фибрин. Активаторы плазминогена находятся под влиянием специфических ингибиторов, главным из которых является ингибитор активатора плазминогена -1, уровенькоторого значительно повышен при сахарном диабете типа 2. Гиперинсулинемия и высокий уровень триглицеридов стимулируют синтез ингибитора активатора плазминогена-1 в различных тканях (гепатоциты, адипоциты, эндотелиоциты). Основным механизмом действия метформина на повышение фибринолиза является снижение уровня ингибитора активатора плазминогена-1 (ИАП-1 или PAI-I) в различных тканях (гепатоциты, адипоциты, эндотелиоциты). Основным механизмом ; влияния метформина на повышение фибринолиза является снижение уровня ингибитора активатора плазминогена-1, что имеет место у больных сахарным диабетом ; типа 2 вне зависимости от его дозы. Помимо снижения активности ингибитора акти- j ватора плазминогена-1, метформин уменьшает также и пролиферацию гладкомы-шечных клеток в сосудистой стенке in vitro и скорость атерогенеза у животных.
Благотворное влияние метформина на фибринолитическую активность крови и сосудистую патологию при сахарном диабете типа 2 были известны давно. Однако на эти аспекты действия метформина было обращено особое внимание лишь благодаря анализу данных проспективного исследования UKPDS (UKPDS 34, 1998). Установлено, что у больных сахарным диабетом типа 2, получавших монотерапию или комбинированную терапию метформином имеется дополнительное на 40% уменьшение риска развития сосудистых осложнений, по сравнению с больными, получавшими терапию сульфонилмочевинными препаратами или инсулином.
Данные о влиянии метформина и других сахароснижающих препаратов, применяемых в исследовании UKPDS, на развитие сердечно-сосудистых осложнений представлены в табл. 30.

Из данных, представленных в табл. 2.47 видно, что терапия метформином приводила к статистически достоверному снижению летальности больных сахарным диабетом типа 2 и снижению риска развития любых осложнений диабета, в том числе, инфаркта миокарда и инсульта. Метформин обладает, дополнительно к сахароснижающему действию, другими положительными эффектами в том числе влиянием как на снижение степени выраженности инсулиновой резистентности и гиперинсулинемии, так и на различные метаболические процессы, включая влиянием на липидный обмен, систему гемостаза и др., чем и объясняется тот факт, что при длительном его применении снижается риск развития всех сосудистых осложнений диабета (UKPDS, 1998, study 34),тогда как на терапии ПСМ или инсулином - лишь риск развития микроангиопатий, но не - макроангиопатий. (UKPDS, 1998, study33).
Исследования показали, что метформин оказывает положительное влияние на течение синдрома поликистозных яичников (СПЯ), при котором инсулинорезистентность является одним из важных компонентов СПЯ, участвуя в его патогенезе. Как показали исследования V. Jayagopal и соавт. (2002) у больных, страдающих СПЯ, выявляется статистически достоверное повышение индекса инсулиновой резистентности при определении его уровня с использованием метода НОМА по сравнению по сравнению с женщинами контрольной группы (5,85 ед против 1,67 ед; Р=0,001).
Метформин оказывает положительный эффект на многие компоненты метаболического синдрома и снижая резистентность к инсулина индуцирует овуляцию у женщин с наличием у них синдрома поликистозных яичников (J. Е. Nestler и соавт., 1998). Метформин, применяемый у подростков с СПЯ в суточной дозе 850 мг 2 раза в день, улучшал чувствительность к инсулину, снижал инсулинемию, восстанавливал нарушенную толерантность к глюкозе и снижал повышенный уровень андрогенов в сыворотке крови (S. A. Arslanian и соавт.,2002). Более того терапия метформином в суточной дозе 1000-2000 мг беременных с СПЯ приводила к статистически достоверному снижению частоты спонтанных абортов (8,8% против 41,9% в контрольной группе; Р<0,001) в ранние сроки беременности по сравнению с беременными женщинами с СПЯ контрольной группы (D. J. Jakubowicz и соавт., 2002).
Ранними экспериментальными исследованиями было показано, что длительное назначение метформина песчанным крысам почти полностью прерывало у них развитие сосудистых нарушений, которые развиваются у них на фоне диабета. Кроме того, у неожирелых КК линейных мышей, имеющих выраженную ин-сулиновую резистентность и нарушение толерантности к глюкозе, назначение метформина предупреждало у них развитие гломерулосклероза, у диабетических собак - препятствовало уплотнению сосудистой стенки, гликированию коллагена и диастолической дисфункции миокарда (G. N. Jyothirmayi и соавт., 1998).
Метформина достоверно уменьшает зону некрозу после перевязки левой коронарной артерии у крыс, улучшает постишемическую реперфузию не только в эксперименте, но и у больных после острой транзиторной ишемии, а при его длительном применении четко выявляется положительный эффект, подтверждаемый улучшением гемодинамики в мелких кровеносных и лимфатических сосудах (С. R. Sirtori и С. Pasik,1994). Указанное влияние метформина независимо от его антигипергликемического действия, что и было подтверждено длительным его применением в терапии сахарного диабета типа 2 (UKPDS, 1998).
Нарушение гемостаза при сахарном диабете типа 2 проявляются тромбозом и ДВС синдромом, что является следствием повышенной агрегации тромбоцитов и гиперкоагуляции (J. A. Colwell, 1993). Показано, что метформин угнетает тромбообразование, a in vivo он в большей степени по сравнению с аспирином или тиклопидином угнетает окклюзию сонной артерии у крыс, вызываемую местной электростимуляцией (L. Massad и соавт., 1988).
Под влиянием метформина у больных сахарным диабетом типа 2 улучшается фибринолиз, который снижен у больных сахарным диабетом типа 2, и ко- ; торый является дополнительным фактором тромбообразования и сосудистых осложнений диабета. Важная роль при этом отводится плазмину, неактивным предшественником которого является плазминоген. Под влиянием активатора плазминогена тканевого и урокиназного типа плазминоген конвертируется в плазмин, растворяя фиксированный фибрин. Активаторы плазминогена на- ; ходятся под влиянием специфических ингибиторов, главным из которых яв- ; ляется ингибитор 1 типа активатора плазминогена, уровень которого значительно повышен при сахарном диабете типа 2. Гиперинсулинемия и высокий | уровень триглицеридов стимулируют синтез ингибитора 1 типа активатора \ плазминогена в различных тканях (гепатоциты, адипоциты, эндотелиоциты). Основным механизмом действия метформина на повышение фибринолиза ! является снижение уровня ингибитора 1 типа активатора плазминогена, что" имеет место у больных сахарным диабетом типа 2 вне зависимости от его' дозы. Это положительное влияние метформина на фибринолиз и снижение: содержания фибриногена (G. Fanghanel и соавт., 1998), уровня ингибитора 1 типа активатора фибриногена проявляется не только у больных сахарным i диабетом типа 2 (F. Gregorio и соавт., 1995), но и у больных, страдающих син- ■ дромом поликистозных яичников (Е. М. Velazquez и соавт., 1997) и ожирением; (P. Vague и соавт., 1987).
К настоящему времени идентифицирован механизм, ответственный за улуч- j шение фибринолиза, наблюдаемого у больных под влиянием терапии метфор-\ мином. Важным в этом направлении является снижение уровня ингибитора; типа 1 активатора плазминогена, который инактивирует активатор тканевого;: плазминогена или tPA (В. Е. Sobel, I999). Повышение уровня ингибитора типа 1: активатора плазминогена отмечается в плазме крови выявляется при сахарном; диабете, ожирении, гипертензии и других патологических состояниях сопро^ вождающихся гиперинсулинемией и инсулиновой резистентностью. Наиболь* шее количество ингибитора типа 1 активатора плазминогена в организме че-*; ловека секретируется адипоцитами висцерального жирового депо, а не депо! подкожной жировой клетчатки. Снижение под влиянием терапии метформином количества висцерального жира сопровождается изменением фибринолиза, содержания фактора Виллебранда и уменьшением концентрации в крови ак-? тиватора тканевого антигена, антигена VII фактора и ингибитора типа 1 актич ватора плазминогена, как у больных сахарным диабетом типа 2, так у больных; ожирением (М. A. Charles и соавт., 1998; P. J. Grant, 1998). Метформин ингиби-j рует in vitro активность XIII фактора и уменьшает содержание как антигена XII) в крови, так и его активность у больных сахарным диабетом типа 2 (Y W. Cho Ц соавт, 1992), что сопровождается снижением тромбообразования. |
Метформин влияет на многие гемореологические показатели крови: нарушение деформируемости и агрегации эритроцитов, вязкости крови, которая, как известно, является ключевым фактором, обеспечивающим качественное снабжение периферических тканей энергетическими и другими веществами, необходимыми для сохранения их функциональной активности. Естественно изменения гемореологических показателей крови, выявляемые у больных сахарным диабетом типа 2 способствуют увеличению времени транзита крови в капиллярах или даже развитию в них стаза и образования микротромбов. Метформин уменьшает деформированность эритроцитов и их агрегацию, вязкость, улучшает фильтрационную способность и флюидность эритроцитарной мембраны (S. Muller и соавт.,1997).
Помимо снижения активности ингибитора 1 типа активатора плазминогена, метформин уменьшает также и пролиферацию гладкомышечных клеток в сосудистой стенке in vitro и скорость атерогенеза у животных. Метформин увеличивает микроциркуляцию в различных органах, включая печень и скелетные мышцы. Это влияние метформина в большей степени проявляется на уровне капилляров, а также и артериол (увеличивается сеть микрососудов), что сопровождается улучшением перфузии и восстановлением функции так называемых «пейсмекерных» клеток, регулирующих циклическую вазодвигатель-ную активность (сокращение/дилатация). Сокращения или дилатации сосудов осуществляется с периодичностью 5-10 циклов в минуту. У больных сахарным I диабетом типа 2 отмечается нарушение вазодвигательной функции артериол, что является одной из причин вовлечения нижних конечностей при диабете в I патологический процесс с развитием диабетической стопы (К. В. Stansberry и соавт.,1996; I. В. Orija и соавт.,1998).
Помимо снижения активности ингибитора 1 типа активатора плазминогена, I метформин уменьшает также и пролиферацию гладко-мышечных клеток в со-i судистой стенке in vitro и скорость атерогенеза у животных.
Что же касается возможности развития лактатацидоза при приеме бигуанидов, то установлено, что последний имеет место при назначении фенформина, применение которого было запрещено в США в 1976 г., а затем и в других странах. Далее за метформином по влиянию на избыточное образование лактата и возможности развития лактатацидоза следует буформин (силубин, адебит, глибутид), который, кстати, обладает самой низкой сахароснижающей активностью из всех бигуанидов. Метформин имеет преимущества, исходя из механизма его действия, перед другими бигуанидами. Он накапливается преимущественно в тонком кишечнике и в слюнных железах, а не в мышцах, которые являются основным местом образования лактата. Более того, метформин усиливая утилизацию глюкозы в слизистой тонкого кишечника, результатом чего является повышение образования лактата. Однако, последний попадая в печень используется для образования глюкозы в процессе глюконеогенеза. При применении метформина для лечения больных сахарным диабетом лактатаци-доз встречается редко. Так, по данным FDA в США с мая 1995г. по 30 июня 1996г. было зарегистрировано 5 случаев лактатацидоза на 100000 больных, получавших этот препарат (RI Misbin и соавт., 1998). При этом из 47 случаев лактатацидоза, сочетающегося с приемом метформина, у 64% больных отмечались заболевания сердца, которые имели место до приема метформина. Популяционные исследования в Швеции, проведенные с 1987 по 1991г., показали, что частота лактатацидоза составляет 2,4 случая на 100000 человек/год. В недавно опубликованной работе J.B.Brown и соавт.(1998) показали, что частота подтвержденного лактатацидоза в США составляет 9,7 случаев на 100000 человек/год у \ больных сахарным диабетом типа 2. Его частота увеличивается до 16,9 случаев ' на 100000 человек/год в случае наличия некетоацидотического или неуреми- ; ческого ацидоза без определения содержания лактата в крови. Как уже отмечалось выше, частота лактат-ацидоза на фоне приема метформина составляет ! около 3 случаев на 100 000 больных или 0,03 на 1000 пациентов в год.
Незначительный риск развития лактатацидоза при лечении метформином поз- | волили вернуться в 1995г. (по решению Food and Drug Administration, США), спустя 20 лет после запрещения использования бигуанидов для лечения сахарного диа- ! бета, к клиническому применению не всех препаратов из этой группы, а только ; метформина (M.Stumvoli и соавт., 1995). Метформин (глюкофаж, сиофор) можно ; сочетать с приемом сульфонилмочевинных препаратов, позволяя лучше ком- I пенсировать углеводный обмен, что является основным условием профилактики поздних (сосудистых) осложнений диабета. Метформин не снижает содержание глюкозы в крови ниже нормального ее уровня, вот почему при лечении больных сахарным диабетом этим препаратом отсутствуют гипогликемические состояния.
Представленное данные свидетельствуют о том, что лечение метформином (глюкофаж, сиофор, формин и др.) дает хороший результат у лиц, страдающих сахарным диабетом типа 2 при избыточной массе тела. Глюкофаж можно применять в виде монотерапии или в сочетании с препаратами сульфанилмочеви-ны, глинидами, акарбозой, тиазолидиндионами и препаратами инсулина. Метформин показан также больным, у которых успешно продолжающееся до этого лечение препаратами сульфанилмочевины перестало давать терапевтический эффект, а также в случае инсулинорезистентности (в сочетании с инсулином).
Проведенное в Великобритании проспективное исследование по лечению больных сахарным диабетом типа 2 (UKPDS) показало, что терапия в течение \ 13 мес метформином в сочетании с инсулином NPH более эффективна, чем терапия гликлазидом в сочетании с инсулином NPH (S. V. O'Brien и соавт,1999). Показатели НЬА1с в обеих группах были одинаковыми - они достоверно снизились на 2% по сравнению с периодом до лечения, но прибавка массы тела в группе больных, леченных метформином и инсулином, была на 5 кг меньше, чем в группе больных, получавших лечение гликлазидом и инсулином.
L. Czypryniak и соавт. (1999) изучали влияние метформином в виде монотерапии и в комбинации с инсулином, сульфонилмочевинными препаратами или \ акарбозой. Они установили, что терапия в течение более 1 года больных диабетом типа 2 сопровождалась улучшением компенсации углеводного обмена, достоверным снижением уровня НЬА1с у всех больных, также снижением массчы тела, особенно у больных с выраженным ожирением.
Применение метформина у больных диабетом типа 2 с сосудистыми поражениями сетчатки ( Т. М. Миленькая и соавт., 1999)способствовало сниже-; нию массы тела, уменьшению содержания холестерина в сыворотке крови, у: 37% больных с непролиферативной диабетической ретинопатией отмечалось'
уменьшение количества твердых экссудативных очагов, ретинальных геморрагии, а у 25% больных с центральной дегенерацией сетчатки - уменьшение экссудативных изменений и отека сетчатки.
Как и препараты сульфанилмочевины бигуаниды подлежат отмене в случаях беременности и лактации, присоединения инфекционных заболеваний, предстоящих оперативных вмешательств.
Побочные явления в результате лечения бигуанидами развиваются значительно реже, чем при других методах терапии диабета. Наблюдающиеся иногда слабовыраженные диспепсические явления, неприятные ощущения в эпигаст-ральной области, металлический вкус во рту и др. проходят при снижении разовых доз препаратов; в некоторых случаях рекомендуется принимать их после еды, запивая достаточным количеством воды.
Следует помнить о возможности развития в связи с приемом бигуанидов тяжелого лактатемического ацидоза, требующего немедленного и интенсивного лечения. Чаще всего молочно-кислый ацидоз развивается при больших дозах бигуанидов, применяющихся не столько для лечения диабета, сколько для подавления аппетита и снижения массы тела, особенно когда такое лечение сочетается с неоправданно низким употреблением углеводов. Риск развития молочнокислого ацидоза увеличивается у больных с почечной или печеночной недостаточностью, а также при наличии условий для развития гипоксии (сердечно-сосудистые заболевания и заболевания легких), поэтому перечисленные сопутствующие заболевания являются абсолютным противопоказанием к применению бигуанидов.
Перечисленные положительные эффекты метформина можно подразделить на:
прямые его эффекты: улучшение фибринолиза, гемореологических показателей, увеличение «питательного» кровотока, снижение скорости развития атеросклероза, неоваскуляризации и тромбообразования, снижения гликиро-вания белков и окислительного стресса и
непрямые эффекты: снижение гликемии, инсулинемии и инсулиновой резистентности. Все перечисленное благоприятно влияет на развитие и прогрессирова-ние сосудистых осложнений диабета и на улучшение постишемических исходов.
Таким образом, метформин (глюкофаж, сиофор, формин и др.) «переживает» в настоящее время второе рождение, которое связано с выявлением новых аспектов его действия, в частности, улучшение транспорта глюкозы через клеточную мембрану, приводящее к повышению утилизации глюкозы периферическими тканями. Это в свою очередь приводит к снижению инсулинорезистентности при сахарном диабете типа 2, которая является одним из основных механизмов его развития. Лучшей компенсации сахарного диабета при применении метформина способствует снижение массы тела. Повышение фибринолиза восстанавливает нарушенную микроциркуляцию, которая обеспечивает нормальное снабжение периферических тканей, как источниками энергии, так и кислорода, необходимого для использования этой энергии.
Представленные данные и наш собственный опыт свидетельствует о целесообразности применения метформина (глюкофажа, формина, сиофора) в лечении сахарного диабета типа 2. К сожалению, наши данные свидетельствуют о том, что в России метформин (глюкофаж, сиофор) применяется в лечении сахарного диабета лишь у 1-3% больных, тогда как за рубежом 10-20% больных сахарным диабетом типа 2 находятся на лечении метформином. В качестве монотерапии он может быть рекомендован как препарат выбора во всех случаях сахарного диабета типа 2, протекающего с избыточной массой тела, когда компенсация сахарного диабета не может быть достигнута только на диетотерапии. Хороший эффект можно получить при сочетании препаратов сульфонилмочевины (манинил 1,75 или 3,5) с метформином, тиозолидиндионами или нсулином. В последние годы появилось несколько сообщений о применении метформина в комплексе с инсулиновой терапии у больных сахарным диабетом типа 1, у которых заболевание протекает как с выраженной инсулиновой резистентностью или без таковой. В этой связи следует указать, что в 70-е годы прошлого столетия отечественные эндокринологи (В.Г. Баранов и др.) применяли бигуаниды в комплексной терапии сахарного диабета типа 1 у детей. Можно ; предсказать, что в течение ближайшего времени международной медицинской ; общественностью будут пересмотрены показания к применению метформина при сахарном диабете типа 1 в дополнении к инсулиновой терапии, особенно в тех случаях, когда нарушение углеводного обмена сочетается с нарушениями липидного обмена, избыточной массой тела, лабильным течением диабета с выраженной инсулиновой резистентностью.
Ингибиторы альфа-глюкозидаз (глюкобай или акарбоза) - третья группа пероральных сахароснижающих препаратов, которые в последние 10-12 лет широко применяют для лечения диабета с целью снижения всасывания из кишечника углеводов
Глюкобай, уменьшает переваривание углеводов в верхнем отделе тонкого кишечника, которые достигают нижних отделов тонкого кишечника, где они могут абсорбироваться. Механизм действия глюкобая (акарбозы) создает такие условия, при которых всасывание углеводов в желудочно-кишечном тракте растягивается во времени, снижая при этом уровень постпрандиальной гипергликемии, т.е. глюкобай как бы «подстраивает» скорость всасывания углеводов из кишечника к сниженной 1 -й фазы секреции инсулина, наблюдаемой у больных СД типа 2. Уменьшая уровень постпрандиальной гипергликемии глюкобай создает условия для снижения глюкозотоксичности и тем самым создает условия для восстановления нарушенной секреции инсулина р-клетками островков поджелудочной железы, что проявляется снижением гиперинсулинемии на фоне терапии глюко-баем, а это в свою очередь проявляется снижением массы тела, что постоянно наблюдается у больных, получающих терапию ингибиторами а-глюкозидаз.
Ингибиторы а-глюкозидаз, снижая активность соответствующих ферментов уменьшают распад углеводов, поступивших в кишечник и тем самым снижают количество свободных моносахаридов, абсорбирующих в кровь, уменьшая тем самым выраженность постабсорбционной гипергликемии. Исследованиями установлено, что около 60% суток приходится на постабсорбционный период и высокая гипергликемия в это время имеет решающее значение как в патогенезе сахарного диабета типа 2, так и его сосудистых осложнений. В одном из основополагающих исследований (Chicago Heart Study), в котором наблюдалось свыше 13000 мужчин и которое продолжалось в течение 22 лет, показано, что показатель летальности от сердечно-сосудистых заболеваний дости-
100 гал 20% в группе лиц, постпрандиальный уровень глюкозы у которых превышал 11,1 ммоль/л (W.H.Pan и соавт.,1986). В другом проспективном исследовании (DECODE Study Group, 2001), в котором участвовало 25000 больных и которое продолжалось в течение 10 лет, была выявлена четкая корреляционная зависимость между постпрандиальным уровнем глюкозы и показателем летальности. Содержание глюкозы в плазме крови через 2 часа после приема пищи является более значимым предиктором развития макроангиопатий и не зависел от показателя уровня глюкозы в плазме крови натощак.
В последнее время показано, что помимо основного действия - ингибирова-ния глюкозидаз, глюкобай улучшает периферическое использование глюкозы посредством повышения экспрессии гена ГЛЮТ-4. Нами проводилась сравнительная оценка действия глюкобая (акарбоза, фирмы «Байер») и плацебо двойным слепым методом у 120 больных СД типа 1 и 180 больных, СД типа 2. Препарат или плацебо назначали по 50 мг/сут, увеличивая на 50 мг 2 раза в сутки в первые 2 нед, а затем по 100 мг 3 раза в день.
Глюкобай снижает абсорбцию большинства углеводов, таких как крахмал, декстрины, мальтоза и сахароза. Глюкобай является аналогом олигосахарида, который имеет высокую аффинность (более чем в 1000 раз) к дисахаридам кишечника. Это конкурентное угнетение а-глюкозидаз снижает постпрандиальное повышение глюкозы в крови. На приеме препарата отмечалось статистически недостоверное снижение гликемии натощак. Однако, снижение гликозилированного НЬА1 (с 10,12+-0,2 до 7,95+-0,16%) и постпрандиальной гликемии было статистически достоверным. Масса тела у больных, получавщих глюкобай, уменьшилась на 2,8 кг (на плацебо-2,0 кг). У больных сахарным диабетом типа 2 под влиянием проводимого лечения содержание в сыворотке крови триглицеридов уменьшилось на 13,3%, холестерина - на 9,8% (в группе плацебо - на 7,9 и 5,3%, соответственно; разница статистически недостоверна). У больных сахарным диабетом типа 1 перечисленные показатели (гликемия натощак и постпрандиальная, уровень НЬА1, небольшое снижение дозы инсулина) под влиянием приема глюкобая улучшились, но эти изменения были статистически недостоверны. Результаты, проведенных исследований свидетельствуют о том, что глюкобай (псевдотетрасахарид, ингибитор а-глюкозидаз) высокоэффективен при лечении больных сахарным диабетом, снижая одновременно как показатели углеводного обмена, так и уровень липидов в крови. Препарат хорошо переносится больными и может применяться для лечения больных СД типа 2 в том случае, когда не удается достичь компенсации углеводного обмена только на диете и адекватной физической нагрузке.
Последующие исследования подтвердили эффективность глюкобая и при длительном его применении (G. Mert.es, 2001). Большая кагорта больных СД типа 2 (1954 больных были включены в исследование, из которых 1096 продолжали находится под наблюдением врачей на окончания 5-летнего срока наблюдения) получали терапию глюкобаем в течение 5 лет. При этом у 1/3 глюкобай применялся в виде монотерапии, а у 2/3 - в комбинации с другими сахароснижающими препаратами. Средние дозы препарата составили 152 мг (50-ЗООмг) в начале лечения и 201 мг (50-300 мг в конце периода наблюдения). У 34% больных СД типа 2, получавших монотерапию глюкобаем содержание НЬА1 с снизилось с 8,4% до 6,6%, т.е. на 1,8%. Гликемия натощак за этот же период снизилась на 2,74 ммоль/л, а уровень постпранлиальной гликемии - на ; 3,42 ммоль/л. Снижение массы тела за наблюдаемый период составил - 0,9 кг. Монотерапия больных СДтипа 2 глюкобаем по эффективности компенсации углеводного обмена (содержание глюкозы в плазме крови и НЬА1 с) сопоставима с данными, полученными при проведении монотерапии больных СДтипа 2 ПСМ или метформином (Н. Е. Lebowitz, 1998). В другом исследовании (J. Hoffmann, \ 1997) установлено, что монотерапия акарбозой или метформином больных СД типа 2 достоверна более эффективна по сравнению с плацебо. Однако с учетом 1 влияния этих препаратов на профиль липидов плазмы и особенно на холесте-ринЛВП, ЛНП и отношение холестерина ЛНП/ЛВП, терапия акарбозой имеет | преимущества перед метформином.
G. S. Meneilly и соавт. (2000) изучали влияние акарбозы (глюкобая) на секре- < цию инсулина и инсулиновую резистентность у 22 больных СД типа 2 пожилого возраста (68+1 год) и у больных контрольной группы, получавших плацебо (возраст 70+1 год) в течение 12 мес. У больных, находящихся на терапии акарбозой отмечалось статистически достоверное снижение гликемии натощак и через 2 часа после приема пищи по сравнению с больными, получавших плацебо. На фоне терапии акарбозой секреция инсулина оставалась практически без изменений, тогда как отмечалось статистически достоверное снижение степени выраженности инсулиновой резистентности, определяемой с помощью клэмп метода. Влияние акарбозы на инсулиновую резистентность, вероятнее всего, i опосредуется несколькими механизмами. Во-первых, это снижение глюкозо-токсичности, как следствие улучшения компенсации углеводного обмена. Во- ; вторых, повышение чувствительности к инсулину может быть следствием увеличения секреции глюкагоноподобного пептида - 1 (ГПП-1 или GLP-1), имеет место при применении акарбозы (С. Н. Qualmann и соавт., 1995). Применение i ГПП-1 сопровождается повышением чувствительности к инсулину (М. A. Nauck ; и соавт, 1997). Помимо этого, под влиянием акарбозы замедляется не только всасывание из кишечника не только углеводов, но и жирных кислот, а последние, как известно, ингибируют секрецию инсулина.
Снижение свободных жирных кислот в крови на фоне терапии акарбозой ; будет благоприятно сказываться на улучшение функции р-клеток и секреции j инсулина. Этому способствует и повышение секреции ГПП-1, который не толь-1 ко повышает чувствительность к инсулину, но и замедляет скорость апоптоза р-клеток в островках поджелудочной железы, способствуя восстановлению их ■ пула и функциональной активности. J К новой группе пероральных сахароснижающих препаратов относятся по-тенциаторы (сенситайзеры) действия инсулина или тиазолидиндионы, которые I повышают чувствительность периферических тканей к инсулину. Они усилива-1 ют действие инсулина в мышцах скелета, жировой ткани и в печени. К препа-1 ратам этой группы относятся росиглитазон и пиоглитазон. Механим действия! тиазолидиндионов заключается в способности этих препаратов взаимодейс-1 твовать с определенным недавно идентифицированным классом ядерных! рецепторов PPARy, играющим основную роль в регуляции дифференцировкй j адипоцитов и обмена липидов. Вместе с ретиноидным X рецептором, PPARy 1 комплексируется с ДНК как гетеродимер, осуществляя функцию транскрипти-ционного фактора, регулируя образование белков, вовлеченных в жировой и углеводный обмен. Считается, что непосредственными генами мишенями для PPARy являются гены, кодирующие липопротеиновую липазу, белок, транспортирующий жирные кислоты, адипофилин, фосфоэнолпируваткарбоксикиназу, возможно, ген резистина и ген субстрата инсулинового рецептора 2 (СИР-2). Оставаясь центральным регулятором адипогенеза, PPARy осуществляет диф-ференцировку преадипоцитов в адипоциты. Эту координирующую роль он оказывает в тесной кооперации с другими факторами транскрипции ( R. Walczak и P. Tontonoz., 2002). Имеется предположение, что помимо регуляции экспрессии генов, глитазоны взаимодействуют также с местами, связывающими инсулин (определенные последовательности в субстратах инсулинового рецептора) и способствуют, таким образом, экспрессии некоторых генов, кодирующих белки, являющиеся мишенью для действия инсулина; в частности, транспортеры глюкозы. Модулируя инсулиновую чувствительность периферических тканей к инсулину, глитазоны участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (а ФНО, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
Установлено, что механизм сахароснижающего и липидоснижающего действия глитазонов обусловлен их влиянием на активируемый пролифератором пероксисом рецептор-у (PPARy). PPARa, PPARy и PPARS относятся к семейству транскрипционных факторов, играющих центральную роль в регуляции адипогенеза. Были проведены исследования по клонированию гена PPARy ряда млекопитающих, включая человека, и установлена его хромосомная локализация (Зр25), Известны три изоформы продукта указанного гена — PPARy-1, PPARy -2 и PPARy-З, которые неравномерно представлены в тканях организма. Практически во всех тканях организма экспрессируется PPARy-1, тогда как PPARy-2 - преимущественно в жировой ткани, а PPARy-З - в жировой ткани, макрофагах и в эпителии толстого кишечника.
Установлено, что изоформы PPARy экспрессируются и в других тканях: сердце, гладких мышц сосудов, селезенке, почках, печени, кишечнике, надпочечниках, скелетных мышцах и моноцитах (D. Auboeuf и соавт.,1997; D. Bishop- Bailey, 2000). Так, в скелетных мышцах количество белка PPARy составляет 67% от его количества в жировой ткани (М. Loviscach и соавт.,2000). Результаты большинства проведенных исследований поддерживают общепринятую точку зрения, что PPARy опосредуют основное действие тиазолидиндионов, проявляющееся в повышении чувствительности к инсулину.
Тиазолидиндионы, также как и бигуаниды, обладают нормализующим влиянием на углеводный и липидный обмены, что позволяло считать некоторым исследователям о близких, если не идентичных, механизмах их биологического влияния. Для ответа на эти вопросы были проведены специальные исследования, которые показали различие некоторых молекулярных механизмов их действия. Так, Т. P. Ciaraldi и соавт. (2002) установили, что у больных сахарным диабетом типа 2, у которых отсутствовал эффект от применения глибенкламида НЬА1 с снизилось с 8,4% до 6,6%, т.е. на 1,8%. Гликемия натощак за этот же период снизилась на 2,74 ммоль/л, а уровень постпранлиальной гликемии - на ; 3,42 ммоль/л. Снижение массы тела за наблюдаемый период составил - 0,9 кг. Монотерапия больных СДтипа 2 глюкобаем по эффективности компенсации углеводного обмена (содержание глюкозы в плазме крови и НЬА1 с) сопоставима с данными, полученными при проведении монотерапии больных СДтипа 2 ПСМ или метформином (Н. Е. Lebowitz, 1998). В другом исследовании (J. Hoffmann, \ 1997) установлено, что монотерапия акарбозой или метформином больных СД типа 2 достоверна более эффективна по сравнению с плацебо. Однако с учетом 1 влияния этих препаратов на профиль липидов плазмы и особенно на холесте-ринЛВП, ЛНП и отношение холестерина ЛНП/ЛВП, терапия акарбозой имеет | преимущества перед метформином.
G. S. Meneilly и соавт. (2000) изучали влияние акарбозы (глюкобая) на секре- < цию инсулина и инсулиновую резистентность у 22 больных СД типа 2 пожилого возраста (68+1 год) и у больных контрольной группы, получавших плацебо (возраст 70+1 год) в течение 12 мес. У больных, находящихся на терапии акарбозой отмечалось статистически достоверное снижение гликемии натощак и через 2 часа после приема пищи по сравнению с больными, получавших плацебо. На фоне терапии акарбозой секреция инсулина оставалась практически без изменений, тогда как отмечалось статистически достоверное снижение степени выраженности инсулиновой резистентности, определяемой с помощью клэмп метода. Влияние акарбозы на инсулиновую резистентность, вероятнее всего, i опосредуется несколькими механизмами. Во-первых, это снижение глюкозо-токсичности, как следствие улучшения компенсации углеводного обмена. Во- ; вторых, повышение чувствительности к инсулину может быть следствием увеличения секреции глюкагоноподобного пептида - 1 (ГПП-1 или GLP-1), имеет место при применении акарбозы (С. Н. Qualmann и соавт., 1995). Применение i ГПП-1 сопровождается повышением чувствительности к инсулину (М. A. Nauck ; и соавт, 1997). Помимо этого, под влиянием акарбозы замедляется не только всасывание из кишечника не только углеводов, но и жирных кислот, а последние, как известно, ингибируют секрецию инсулина.
Снижение свободных жирных кислот в крови на фоне терапии акарбозой ; будет благоприятно сказываться на улучшение функции р-клеток и секреции j инсулина. Этому способствует и повышение секреции ГПП-1, который не толь-1 ко повышает чувствительность к инсулину, но и замедляет скорость апоптоза р-клеток в островках поджелудочной железы, способствуя восстановлению их ■ пула и функциональной активности. J К новой группе пероральных сахароснижающих препаратов относятся по-тенциаторы (сенситайзеры) действия инсулина или тиазолидиндионы, которые I повышают чувствительность периферических тканей к инсулину. Они усилива-1 ют действие инсулина в мышцах скелета, жировой ткани и в печени. К препа-1 ратам этой группы относятся росиглитазон и пиоглитазон. Механим действия! тиазолидиндионов заключается в способности этих препаратов взаимодейс-1 твовать с определенным недавно идентифицированным классом ядерных! рецепторов PPARy, играющим основную роль в регуляции дифференцировкй j адипоцитов и обмена липидов. Вместе с ретиноидным X рецептором, PPARy 1 комплексируется с ДНК как гетеродимер, осуществляя функцию транскрипти-ционного фактора, регулируя образование белков, вовлеченных в жировой и углеводный обмен. Считается, что непосредственными генами мишенями для PPARy являются гены, кодирующие липопротеиновую липазу, белок, транспортирующий жирные кислоты, адипофилин, фосфоэнолпируваткарбоксикиназу, возможно, ген резистина и ген субстрата инсулинового рецептора 2 (СИР-2). Оставаясь центральным регулятором адипогенеза, PPARy осуществляет диф-ференцировку преадипоцитов в адипоциты. Эту координирующую роль он оказывает в тесной кооперации с другими факторами транскрипции ( R. Walczak и P. Tontonoz., 2002). Имеется предположение, что помимо регуляции экспрессии генов, глитазоны взаимодействуют также с местами, связывающими инсулин (определенные последовательности в субстратах инсулинового рецептора) и способствуют, таким образом, экспрессии некоторых генов, кодирующих белки, являющиеся мишенью для действия инсулина; в частности, транспортеры глюкозы. Модулируя инсулиновую чувствительность периферических тканей к инсулину, глитазоны участвуют также в регуляции эндокринной функции жировой ткани, изменяя секрецию соответствующих гормонов жировой ткани (а ФИО, ингибитор 1 типа активатора плазминогена, адипонектин, лептин и др.), что влияет на снижение скорости развития сосудистых осложнений диабета, вплоть до возможности их обратного развития.
Установлено, что механизм сахароснижающего и липидоснижающего действия глитазонов обусловлен их влиянием на активируемый пролифератором пероксисом рецептор-у (PPARy). PPARa, PPARy и PPARS относятся к семейству транскрипционных факторов, играющих центральную роль в регуляции адипогенеза. Были проведены исследования по клонированию гена PPARy ряда млекопитающих, включая человека, и установлена его хромосомная локализация (Зр25), Известны три изоформы продукта указанного гена — PPARy-1, PPARy -2 и PPARy-З, которые неравномерно представлены в тканях организма. Практически во всех тканях организма экспрессируется PPARy-1, тогда как PPARy-2 - преимущественно в жировой ткани, а PPARy-З - в жировой ткани, макрофагах и в эпителии толстого кишечника.
Установлено, что изоформы PPARy экспрессируются и в других тканях: сердце, гладких мышц сосудов, селезенке, почках, печени, кишечнике, надпочечниках, скелетных мышцах и моноцитах (D. Auboeuf и соавт.,1997; D. Bishop- Bailey, 2000). Так, в скелетных мышцах количество белка PPARy составляет 67% от его количества в жировой ткани (М. Loviscach и соавт.,2000). Результаты большинства проведенных исследований поддерживают общепринятую точку зрения, что PPARy опосредуют основное действие тиазолидиндионов, проявляющееся в повышении чувствительности к инсулину.
Тиазолидиндионы, также как и бигуаниды, обладают нормализующим влиянием на углеводный и липидный обмены, что позволяло считать некоторым исследователям о близких, если не идентичных, механизмах их биологического влияния. Для ответа на эти вопросы были проведены специальные исследования, которые показали различие некоторых молекулярных механизмов их действия. Так, Т. P. Ciaraldi и соавт. (2002) установили, что у больных сахарным диабетом типа 2, у которых отсутствовал эффект от применения глибенкламида,
У большей части больных вторичная резистентность к сахароснижающим пероральным препаратам протекает со сниженной сотаточной секрецией инсулина и С- пептида, тогда как антитела к клеточным антигенам островков поджелудочной железы отсутствуют. Исходя из особенностей клинического течения болезни, этих больных можно разделить на 2 группы: 1) больные диабетом типа 2 с временной инсулинопотребностью; 2) больные с постоянной потребностью в инсулине или даже с инсулинозависимостью ( LADA-подтип).
Первую группу составляют больные с диабетом длительностью 10 лет и более и имеющие избыточную массу тела. Для компенсации углеводного обмена рекомендуется в этих случаях две лечебные тактики. Первая - полный перевод больных на инсулинотерапию в течение небольшого времени ( 2,5-4 месяца). Этого времени бывает достаточно для снятия глюкозотоксичности и восстановления чувствительности р-клеток к препаратам сульфонилмочевины и восстановления резервных возможностей островков поджелудочной железы. Обязательным условием для снятия глюкозотоксичности является достижение полной компенсации сахарного диабета в период проведения инсулинотерапии. В дальнейшем больных вновь переводят на пероральную терапию с хорошими или удовлетворительными результатами компенсации. Восстановлению функциональной активности островкового аппарата поджелудочной железы способствует, как отмечено выше, назначение никотйнамида или препаратов витамина Е.
Вторая тактика заключается в проведении комбинированной терапии инсулином и пероральными сахароснижающими препаратами. В случае наличия у больных избыточного веса предпочтение следует отдавать препаратам из: группы бигуанидов или тиазолидиндионов, особенно препарату авандиа, при приеме которого доказано улучшение функциональной активности островко-1; вого аппарата поджелудочной железы. Нами в течение многих лет для лечения) больных СДтипа 2 со вторичной резистентностью к пероральным препаратам;; используются обе тактики. Мы использовали комбинированную терапию ин-; сулином в суточной дозе, как правило, не более 30 ед. в сутки (обычно инсу^ лин средней продолжительности действия: лента, монотард, протофан и др.);'! Более целесообразно инсулин назначать на ночь, т.е. в 22 или 23 часа. На-| чало действия такого препарата инсулина приходиться на утренние часа или на тот период, когда имеет место избыточное образование глюкозы печенью| Результатом этого является значительное снижение гликемии натощак. В не-| которых случаях необходимо двухкратное введение указанных препаратов] инсулина (утром и в 22-23 часа). В течение дня для поддержания сахаросни-1 жающего эффекта рекомендуется прием бигуанидов, тиазолидиндионов! ПСМ или лучше прандиальных регуляторов люкозы (новонорм или старликс) а обычных терапевтических дозах. j Таким образом, перевод больных СД типа 2 в случае необходимости на mi сулиновую терапию может быть осуществлен в виде следующих схем: ,| 1) отмена приема пероральных сахароснижающих препаратов и назначение':
• инсулин НПХ из расчета 0,2 ЕД/ кг или комбинированные препараты инсулина (микстард 30; инсуман комб 25/75 и др.), при этом 2/3 от суточной дозв инсулина ввести перед завтраком и 1/3 - перед ужином;
• в случае необходимости повышение дозы инсулина на 2-4 ЕД каждые 3-4 дня;
в случае сохранения повышенной постпрандиальной гликемии предпочтение следует отдавать препаратам инсулина комбинированного действия,
