
- •2.Эксергия отс.
- •4. Реальные газы и пары. Р-V и т-s диаграммы. Изображение основных процессов.
- •5. Энерг.Хар-ки термод. Сис– мы и внеш. Возд-вии на нее.
- •6. Реальные газы и пары. Р-V и т-s диаграммы. Изображение основных процессов.
- •11. Тепловые воздевия на термод. С . Энтропия.
- •12. Дрос-ие газов и паров. Физика пр-са. Изменение т/д парам-ов. Темпе-ра инверсии
- •14. Дросселиров газов и паров. Диффер-ный дрос. – эффект и интегр-ный дрос. – эффект.
- •15.1 Зак терм-ки в приложении к закрытым тд-ким сист.
- •16.Ид газы. Анализ политропного процесса.
- •17.1 Зак терм-ки в приложении к закрытым тд-им системам.
- •21 Свободн е и свобод энтальпия. Связанная е. Их физич смысл и практическое применение.
- •26.Идеальные газы. Взаимосвязь теплоемкости процесса и показателя политропы. Способы опред.Показателя политропы.
- •29. Теплоемкость газов. Уравнение Майера.
- •30. Ид. Газы. Расчет изменения энтропии в политропных процессах
- •32. Ид. Газы. Методика анализа особ-ей прев-ий эн при разл-х знач-ях показ-ля политропы
- •33. Расчет тд-их параметров газовых смесей(теплоемкость, молярная масса).
- •34. Влаж. Воздух. Способы задания его парам-ов. Абсол. И относ. Влажность.
- •36. Вл.Возд. Расчет т/д парам-ов вл. Возд. (молярка, плотность, газ.Пост., теплоемкость, энтал).
- •37. Диф. Уравнения т/д. Уравнения взаимосвязи 3-х частных производных.
- •38. Вл.Воздух. Dh – диаграмма. Кондицир-ие воздуха
- •42.Термод-кие основы работы тепловых двигателей. Циклы тепловых двигателей, и их эфф-ность. Основные элементы теплового двигателя и принцип преобразования в них энергии.
- •44. Т/д осн. Раб.Теп.Двг. Прямой обратимый цикл Карно и его роль. Сравнение с другими идеальными циклами теп. Двг.
- •2 Вида параметров состояния: координаты тд-ого состояния и потенциалы вд-й.
- •50. Эксергия з т с.
- •52. Энерг.Хар-ки термод. С/с – мы и внеш. Возд-вии на нее.
- •53. Расчет тд-х параметров газовых смесей(теплоемкость, молярная масса).
1. Тд сист- та совок макроскоп-х тел, кот явл-ся объектом тд-ого анализа в кажд конкретном случае.
Объектом изучения в технич тд-ке часто явл-ся какое-л в-во, выполняющее гл функц в тепловой машине: пар, продукты сгорания топлива, сжатый газ.Такое в-во называется рабочим телом.
Тела, не входящие в состав изучаемой тд-ой системы, объединяются общим понятием «окр среда».
Сист, обладающие 2 степ своб (термической и деформацион), наз простыми или термодеформационными.
Совок физ-х величин, по кот мож отличить данную систему от др, а также проследить за изменениями, возникающими в сист при ее вд-ии с окр ср, характеризует состояние тд сист.
Условием равновесн сост явл равномерное распредел по сист тех физ-х величин, различие в кот явл причиной обмена энергией.
В неравновесн состоянии знач темп-ры, давл, уд объема и др. параметров состояния различны в разных местах ТС.
Физ-ие величины, знач кот однозначно определяются состоянием системы и не зависят от ее предыстории, наз парам сост или функц-ми сост сист.
2 вида параметров состояния: координаты тд-ого состояния и потенциалы вд-й.
Парам состояния, обязательно изменяющиеся при налич вд-я данного рода и не изменяющиеся под влиянием вд-я иных родов, называются коорд тд-ого сост.
Потенциалом вд-я некот рода наз параметр сост, различие значений кот м\у сист и окр ср на контрольной пов-ти приводит к возникновению вд-я данного рода, т.е. к передаче Е в данной форме м\у сист и окр ср.
Ур-я, представляющие зав-ть параметров (функций) состояния равновесной сист от независимых параметров состояния, называются уравнениями состояния тд-ой сист
Если обозн произвольн функц состояния сист через φ, а коорд состояния -- через x1, x2, …, xn (п - число координат состояния, т. е. тд-х степ своб), то Ур-е состояния м предст в виде : φ = φ (x1, x2, …, xn ).
Тд-м процессом наз изменение состояния тд-ой системы в рез-те ее вд-ия с окр ср.
Тд-й процесс, протекающий с нарушением внутреннего равновесия в тд-ой сист, наз неравновесным
Тд-й процесс, протекающий с бесконечно малым отклонением состояния системы от равновесного состояния, называется равновесным.
2.Эксергия отс.

E*=m(U+PV+w2/2+gh)
ΔΕ*=Qе-Lе
В открытой т/д сист. помимо внутр. Е дополнительными источ –ми получения работы явл.: P1V1 – эн. проталкивания, gh1 – потенц.эн., w2/2 – кин. эн.
Эти источники не
связаны с хоатич. формой движ–я →эти
энерг.величины полностью превратимы в
полез.работу.
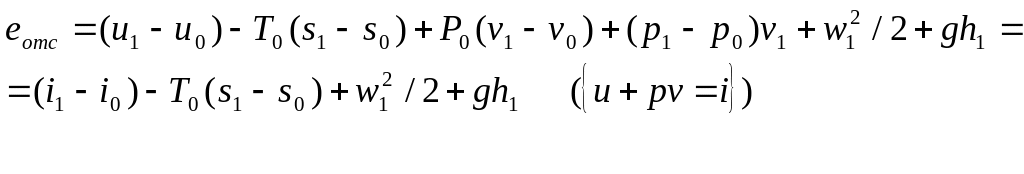
- полное выражение
Во многих задачах i1>>gh1, w12/2<<i1→м. пренебречь.
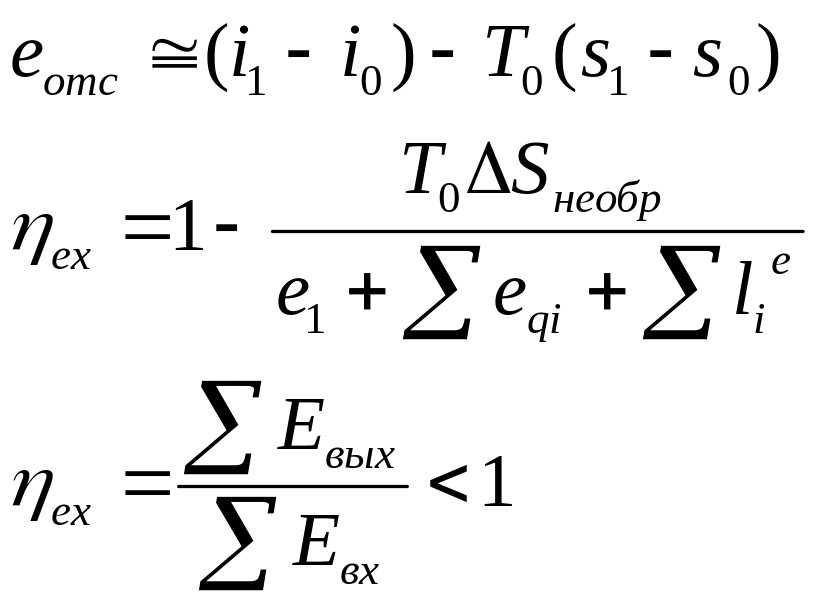
3. Ид газ – это такой газ, м/у молекулами к-го не сущ-т силового вд-я, а сами молекулы не облад ни объемом, ни массой и для к-го уравнение состояния записывается так:
pV=(m/M)RT=mŘT, где R=8,314 Дж/(моль·К), Ř=R/M
или pV =μRT, где μ=m/M
или pυ=RT/M, где υ=V/m
или pύ=RT, где ύ=V/μ
4. Реальные газы и пары. Р-V и т-s диаграммы. Изображение основных процессов.
Уравнение Менделеева-Клайперона уже несправедливо.
Т/д параметры (энт-я, вн.эн.) зависит от 2- парам-в, а не только от тем-ры как для ид-го газа. u=f(P,T)
Тепл-сти Ср и Сv, а следовательно и показ-ль адиабатные не явл-ся пост-ми вел-ми. cP,cV=f(T,P)
В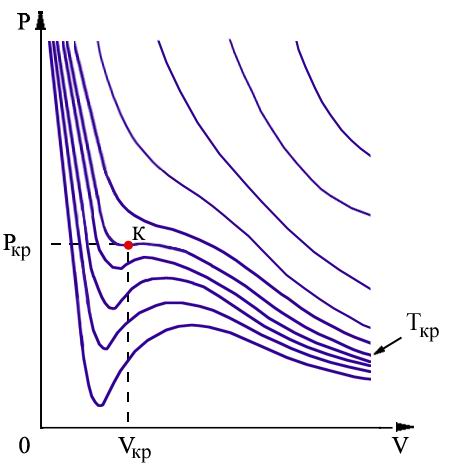 се
рельные газы явл-ся парами тех или иных
жидкостей. Причем чем ближе газ к переходу
в жидкое сост-ие, тем больше его отклонение
от сост-ия идеального газа.
се
рельные газы явл-ся парами тех или иных
жидкостей. Причем чем ближе газ к переходу
в жидкое сост-ие, тем больше его отклонение
от сост-ия идеального газа.
ав- подогрев воды
вс- парообразование
сd- перегрев пара
5. Энерг.Хар-ки термод. Сис– мы и внеш. Возд-вии на нее.
Терм. сис. – объект, кот.выбирает терм-ка – это совок-ть макротел, отдельное макротело или его часть. Энерг.хар-ки: энергия (внутр.эн.). Энергия явл мерой различных форм движения материи. Полная энергия макросистемы: E=Eкин + Епот +U, где U – внутр.эн. Внутр.эн. – это энергия заключенная в с/с. Она состоит из:
1) кинетич.Е поступат, вращат. и колебат.движения молекул.
2) потенциал.энерг.вд-я молекул м/у собой (силы притяж и отталкив ). Свойства внутр.эн.
U=f(T,ν) U=f(P,T) U=f(P,ν) U – функц состояния 1) ΔU= U2 – U1, т.е.не зависит от пути
перехода
2)![]() свойство полного диф –ла :
свойство полного диф –ла :

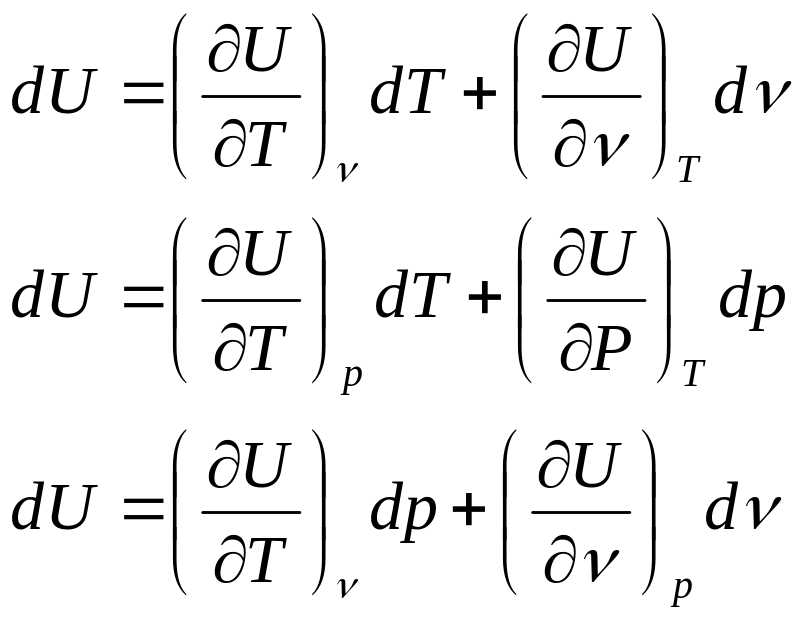
3) для ид.газа : U=f(T)
4)свойство
аддетивности:
![]()
т .е.для
сложной сис внутр.эн.есть сумма
внутр.энергий, составляющих частей этой
сис ΔU
> 0, если U2
> U1.
Энерг.внеш.возд–вие:
.е.для
сложной сис внутр.эн.есть сумма
внутр.энергий, составляющих частей этой
сис ΔU
> 0, если U2
> U1.
Энерг.внеш.возд–вие:
1) тепловое возд. – передача Е за счет хаотич –го неупор – го движ –я частиц. Такая передача Е происходит м/у телами, имеюш –ми различ-ю t-ру , либо м/у телами на расст –ии посредством эл.магн.волн. Передача Е происходит от более нагретых тел к менее нагретым. Кол – во Е при такой передаче наз.кол –вом теплоты.
2) Работа
– передача
Е за счет строго упоряд – го движ – я
частиц. В этом сл –е передача Е происходит
при перемещ всего тела или его части в
простр –ве. Возд – вий в виде работы
очень много. Lмагн,
Lвращ,
Lмех
и др., [Дж]. Работа, затраченная телом
‘+’, а совершенная телом ‘-’ . Ур
возд – вия:
![]()
Рк
– силы (потенциалы), кот.связаны с
внеш.возд. Хк
– коор –та,
предт – ет собой конкр.- й пар –р,
кот.изменяется соот – но этому виду
возд – вия. Рк
– причины возник – я внеш.- х возд- вий.
Возд – вия возникают тогда, когда есть
разность сил. ΔРк=
Рек
– Рiк
, Хек
– следствие возд –.
сильное неравномерное
возд.→ в с/с протекаеют неравн –е
процессы.
![]() -
хар.степень нерав –ти.
-
хар.степень нерав –ти.
к=2
- термодиф – формация с/с (м.б.откр.и закрытой) Число независимых пар – ров с/с (степеней свободы)= числу внеш. энерг- ких возд –вий.
