
- •Содержание
- •Тканевый уровень организации …………………………….…78
- •3.Свойства живых организмов
- •4.Уровни организации живого
- •1. Биологические молекулы. Последовательность молекулярной организации клеток
- •2 Биологическая специфика молекулярного уровня
- •1 История изучения клетки
- •2 Основные положения: современной клеточной теории
- •3 Типы существующих клеток и их общая структура.
- •Строение биологических мембран.
- •Функции биологических мембран. Транспорт через мембрану
- •Транспортная функция мембран
- •Строение животной и растительной клетки
- •7 Ядерный аппарат клетки и рибосомы.
- •Мембранные органоиды клетки
- •Питание клетки. Фагоцитоз и пиноцитоз.
- •1. Эпителиальная ткань.
- •2. Соединительные ткани
- •5. Мышечная ткань
- •6. Нервная ткань
- •2.Периоды онтогенеза
- •3 Старение организма и продолжительность жизни.
- •3. Наследственность и изменчивость и методы их изучения.
- •2 Роль и значение микроорганизмов вокруг нас.
- •3 Отличительные признаки прокариот и эукариот
- •4 Грибы. Строение клетки и тела гриба. Способы размножения грибов.
- •5 Элементы классификации грибов. Представители низших грибов, особенности их строения.
- •6 Аскомицеты. Дрожжи.
- •7 Несовершенные грибы
- •5. Поверхностные структуры бактерий
- •6.Капсула бактерий
- •Клеточная стенка
- •Биологическая химия
- •1. Основы химии
- •Строение атома
- •1.1.1. Ионная связь
- •1.1.2 Ковалентные связи
- •1.1.3. Химические уравнения
- •1.1.4 Кислоты, основания, соли, рН и буферы
- •Окисление и восстановление
- •1.2.1 Окисление
- •1.2.2 Восстановление
- •1.4 Растворы и коллоидное состояние
- •1.5 Диффузия и осмос
- •1.5.1 Диффузия
- •1.6. Законы термодинамики
- •1.6.1 Энергетические соотношения в живых системах
- •1.6.2 Потенциальная энергия
1.1.1. Ионная связь
При возникновении ионных связей электроны передаются от одного атома к другому. Рассмотрим реакцию между натрием и хлором (рис. П. 1.2, А). Атом натрия, теряя электрон, получает положительный заряд +1 (его ядро, содержащее 11 положительно заряженных протонов, окружено теперь 10 отрицательно заряженными электронами). Атом хлора, приобретая электрон, получает отрицательный заряд — 1. У обоих атомов внешние оболочки оказываются заполненными и, следовательно, стабильными.
Такие заряженные частицы уже не являются настоящими атомами. Их называют ионами. Ион натрия обозначают Na+, а ион хлора (хлорид-ион) — С1- Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами. Соединение, образовавшееся в результате реакции между натрием и хлором, называют хлоридом натрия (его формула — NaС1), но молекул NаС1 не существует. Вместо молекул кристаллическая решетка хлорида натрия состоит из ионов натрия и хлорид-ионов в равных соотношениях (ионная формула— Nа+С1-). Подобные соединения, образовавшиеся в результате переноса электронов, называются ионными соединениями. Образуются они главным образом тогда, когда металлы реагируют с неметаллами. Металл образует катион, а неметалл — анион. Все соли представляют собой ионные соединения. ,
Другим типичным примером ионного соединения может служить хлорид кальция — СаСl (рис. П. 1.2, Б). В этом случае атом кальция теряет два электрона, а каждый атом хлора приобретает по одному. Ион кальция обозначают поэтому Са++ или Са2+.
Число передаваемых электронов (которые приобретаются или теряются) характеризует валентность атома, т. е. его способность к образованию химических связей. Из сказанного выше видно, что натрий и хлор одновалентны, а кальций — двухвалентен. Таким образом, число, стоящее в символе иона перед знаком «плюс» или «минус», указывает его валентность; например, валентность иона калия и гидроксид-иона (К+ и ОН-) равна 1, валентность иона магния и сульфат-иона (Мg2+ и SО42-) равна 2, а валентность иона алюминия (Аl3+) равна 3.
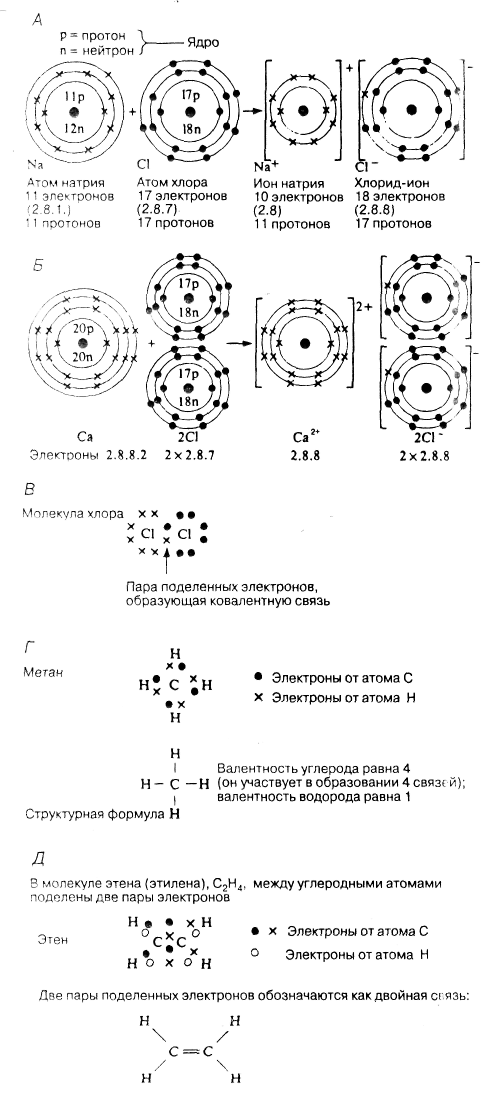
Рис 2. А.Образование хлорида натрия. Б.Образование хлорида кальция. В.Образование молекулы хлора. Г. Формула метана. Д. Формула этена. Для наглядности электроны, принадлежащие разным атомам, обозначены разными значками (крестиком, черными или белыми кружками). В действительности все электроны одинаковы. На рис. В, Г и Д показаны только внешние электронные оболочки.
Ионные формулы
Ионные соединения существуют не в молекулярной, а в ионной форме. Ионная формула показывает соотношение, в котором элементы входят в данное соединение; например, ионная формула оксида алюминия, АlОз, означает, что ионы А13+ и О2- входят в это соединение в соотношении 2:3. Если ион состоит из нескольких атомов, как, например, сульфат-ион (SО42-), и если таких ионов в соединении несколько, то в ионной формуле используются скобки, например Аl2(SО4)3; в ионной формуле Na2SO4 скобки не нужны, поскольку в этом соединении присутствует только один сульфат-ион.
