
- •Методы исследования в микробиологии
- •Техника безопасности при работе с биологическим материалом
- •Характеристика уровней биобезопасности
- •Забор, хранение и транспортировка материала для микробиологического исследования
- •Микроскопический (бактериоскопический) метод исследования (бсми)
- •1 Этап бсми. Забор, хранение и транспортировка материала.
- •2 Этап бсми. Приготовление микропрепаратов.
- •1) Препараты, позволяющие изучать микроорганизмы в убитом состоянии:
- •Препараты, позволяющие изучать микроорганизмы в живом состоянии:
- •Сложные методы окраски клеточных структур бактерий
- •Сравнение электронного и светового микроскопов
- •4 Этап бсми. Заключение.
- •Культивирование микроорганизмов на питательных средах
- •Классификации питательных сред
- •I. По происхождению:
- •II. По составу:
- •III. По консистенции:
- •IV. По назначению:
- •Наиболее часто используемые индикаторы рН в питательных средах
- •Среды для получения изолированных колоний.
- •Среды для накопления чистой культуры.
- •Среды для идентификации микроорганизмов.
- •Признаки колоний микроорганизмов
- •Методы выделения чистых культур аэробных и факультативно-анаэробных микроорганизмов
- •I. Методы механического разобщения бактерий.
- •Методы выделения чистых культур облигатно-анаэробных микроорганизмов
- •Культуральный (бактериологический) метод исследования
- •I. Этапы блми при выделении чистой культуры аэробов и факультативных анаэробов.
- •1 Этап.
- •2 Этап.
- •3 Этап.
- •Признаки, учитываемые при идентификации микроорганизмов (критерии вида)
- •4 Этап.
- •II. Этапы блми при выделении чистой культуры облигатных анаэробов.
- •1 Этап.
- •2 Этап.
- •Биохимическая идентификация микроорганизмов
- •Идентификация микроорганизмов без выделения чистой культуры
- •Принципы молекулярно-генетического анализа
- •Классификация молекулярно-генетических методов
- •Методы, основанные на изучении фрагментов днк.
- •Методы, основанные на гибридизации нуклеиновых кислот.
- •III. Методы, основанные на амплификации нуклеиновых кислот.
- •Характеристика стадий пцр
- •IV. Методы анализа амплифицированных фрагментов.
- •V. Методы, основанные на определении последовательности нуклеотидов в днк, рнк и аминокислот в белках.
- •VI. Методы, основанные на модификации генетической информации.
- •Характеристика штаммов e. Сoli, участсвующих в процессе конъюгации
- •Определение факторов патогенности бактерий
- •5. Капсула.
- •7. Изучение неизвестных токсинов и других факторов патогенности микроорганизмов, механизмы действия которых недостаточно изучены.
- •Методы изучения чувствительности бактерий к антибиотикам
- •Классификация методов определения
- •Основные понятия
- •Дискодиффузионный метод
- •Пропорционален антибиотикочувствитель-ности микроорганизма
- •Метод разведений в агаре
- •Метод разведений в жидких средах
- •Ускоренный метод
- •Автоматизированнный метод с использованием автоматических микробиологических анализаторов
- •Генетические методы
- •Состав питательной среды:
- •Величина посевной дозы и состояние тест-микроорганизмов (инокулюм-эффект):
- •Условия инкубации:
- •Биологический (экспериментальный) метод исследования
- •1 Этап эсми. Взятие и обработка материала.
- •2 Этап эсми. Выбор и заражение лабораторного животного.
- •3 Этап эсми.
- •Общие принципы серологического метода исследования
- •Определение активности гуморального поствакцинального индивидуального или коллективного иммунитета;
- •Определение титров диагностических, лечебных и профилактических сывороток;
- •I. Достоинства слми:
- •II. Недостатки слми:
- •Наличие ложных результатов:
- •Общие принципы аллергологического метода исследования
- •I этап алми. Сбор аллергологического анамнеза с целью:
- •Достоинства алми:
- •II. Недостатки алми:
- •Оглавление
Характеристика стадий пцр
Стадия |
Температура, 0С |
Экспо-зиция |
Описание стадии |
|
Начальная денатурация |
90–95 |
3–10 мин |
Большие двухцепочечные молекулы ДНК раскручиваются с образованием одноцепочечных молекул. |
|
25–40 циклов |
денатурация |
90–95 |
25с– 1 мин |
Небольшие двухцепочечные ампликоны раскручиваются с образованием одноцепочечных молекул. |
отжиг |
48–65i |
25с– 4 мин |
Праймеры прикрепляются к комплементарным фрагментам ДНК-матрицы, образуя дуплексы. |
|
элонгация |
72 |
25с 4 мин |
ДНК полимераза прикрепляется к 3’-концу праймера, соединившегося с ДНК-матрицей, и синтезирует копию, комплементарную ДНК-матрице. |
|
Конечная элонгация |
72 |
510 мин |
Образуются дуплексы ДНК. |
|
Хранение |
4 |
- |
- |
|
Примечание. температура отжига зависит от нуклеотидного состава праймера и рассчитывается математически.
4
Рис.
34.
Источник
тока и камера для электрофореза
Рис.
35.
Камера
для электрофореза с агарозным гелем
5 этап. Анализ и интерпретация результатов реакции (рис. 36). Для оценки результатов учитывают опытные лунки, а также лунки с положительным и отрицательным контролем (рис. 37, табл. 14).
Рис. 36. Автоматизированная система визуализация гелей –
трансиллюминатор, видеокамера, компьютер
Таблица 14
Анализ результатов
ПЦР
Образцы
Светящиеся
оранжевые полосы определенной
молекулярной массы
Отрицательный
контроль
должны
отсутствовать
Положительный
контроль
должны
присутствовать
Опытные образцы
положительные
присутствуют
Опытные образцы
отрицательные
отсутствуют
1 2
3 4 5
Рис.
37.
Электрофореграмма продуктов ПЦР при
диагностике возбудителя бактериальной
инфекции:
1- маркер
молекулярного веса; 2 - положительный
контроль; 3 – результат положительный;
4 - результат отрицательный; 5 –
отрицательный контроль
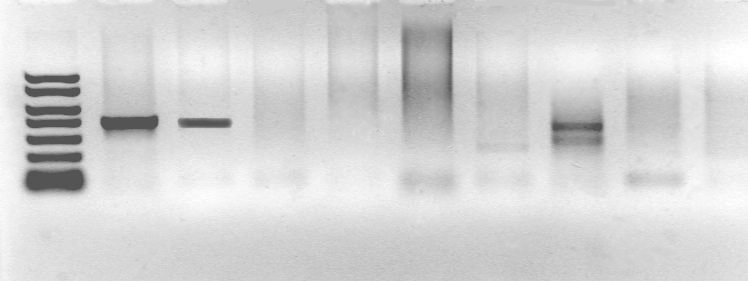
Рис.
24.
Электрофореграмма
продуктов ПЦР при диагностике возбудителя
бактериальной инфекции: 1-3
– результат положительный; 4, 5 –
результат отрицательный; 6 – отрицательный
контроль; 7
– положительный
контроль.
При интерпретации результатов ПЦР следует помнить, что могут быть получены как ложноположительные, так и ложноотрицательные результаты.
Ложноположительные результаты могут наблюдаться в результате контаминации при нарушении правил проведения ПЦР. Ложноотрицательные результаты могут наблюдаться в результате снижения чувствительности ПЦР при ингибировании реакции компонентами биологических образцов.
Модификации ПЦР:
классическая (specific PCR) - амплификация участков ДНК размером до 5000 п.о. с использованием одной пары праймеров.
мультипраймерная (multiplex PCR) – одновременное использование нескольких пар праймеров в одной реакционной пробирке. Это позволяет проводить одновременную амплификацию ДНК различных возбудителей, что сокращает время и расход реактивов. Например, мПЦР для диагностики гнойных менингитов одновременно определяет ДНК наиболее вероятных возбудителей бактериальных менингитов: Neisseria meningitides, Haemophilus influenzae, Streptococcus pneumoniae.
широкодиапазонная использование универсальных праймеров, взаимодействующих с высоко консервативными участками ДНК, встречающимися у многих микроорганизмов. Применяют для выявления в клиническом материале от больного микроорганизмов, в том числе неизвестных и некультивируемых. Обычно мишенью для ПЦР являются гены, кодирующие рибосомы 16S и 23S, имеющие сходную структуру у различных прокариот.
с обратной транскрипцией – используется для обнаружения РНК у РНК-вирусов. Первоначально при помощи РНК-зависимой ДНК-полимеразы (обратной транскриптазы или ревертазы) синтезируют комплементарную ДНК, которую затем используют в стандартной ПЦР.
гнездовая – обладает большей чувствительностью и специфичностью, т. к. проводится последовательно с двумя разными парами праймеров. ДНК продукты, образуемые в первой ПЦР, взаимодействуют со второй парой праймеров.
в реальном времени – используется для определения точечных мутаций, количественного содержания ДНК в пробе, а также для определения уровня экспрессии генов. Этот тип ПЦР находит все большее распространение, так как выявление ампликонов осуществляется по флюоресценции зондов либо красителя SybrGreen и не требует проведения электрофореза (сокращается время и трудоёмкость анализа).
ПП-ПЦР или ПЦР с использованием произвольных праймеров (RAPD-анализ полиморфизма случайно амплифицированной ДНК) – основана на использовании коротких праймеров, длиной 9–10 п. о., способных связаться с разными участками ДНК при низкой температуре отжига. В результате RAPD-анализа происходят амплификации нуклеотидных последовательностей в различных областях генома и образуются многочисленные фрагменты разной длины, по количеству и размерам которых судят о групповой или видовой принадлежности микроорганизма.
ассиимметричная – один из праймеров берут в концентрации в 10 раз большей, чем другой, чем добиваются преобладания среди продуктов реакции одноцепочечных ДНК над дуплексами.
