
lekcii dlya zaochnogo farmfakulteta
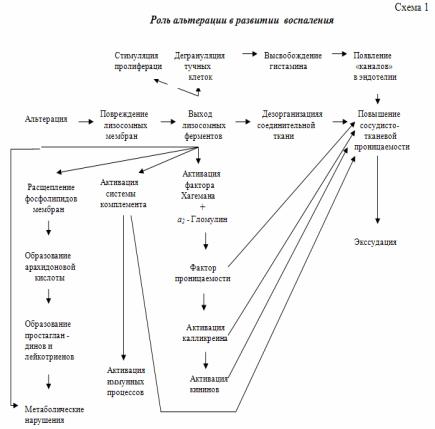
.pdfэлементы соединительной ткани (коллаген, протеогликаны, гликозамингликаны). Повреждение клеток сопровождается нарушением окислительно-восстановительных процессов, поэтому в участке повреждения накапливаются кислые продукты, которые в норме полностью окисляются в цикле Кребса: пировиноградная, альфа-кетоглютаровая, янтарная и другие органические кислоты. Усиление липолиза приводит к накоплению жирных кислот. Все это вызывает в поврежденных тканях развитие сначала компенсированного, а затем и декомпенсированного ацидоза. Усиление распада белковых структур приводит к увеличению молекулярной, а освобождение электролитов из погибших клеток – к росту ионной концентрации межклеточной жидкости и соответственно к увеличению в ней осмотического давления (гиперосмии). Поскольку в кислой среде увеличивается гидрофильность коллоидов и наблюдается увеличенный выход плазменных белков, то одновременно с гиперосмией развивается и гиперонкия тканей.
Изменяются и многие другие физиологические параметры, многие из которых выступают в качестве движущих (патогенетических) факторов воспалительной реакции, на что обратил внимание Г. Шаде, который еще в начале ХХ столетия исследовал закономерности обмена веществ при воспалении. Тогда и возникло представление о воспалении как о своеобразном пожаре обмена, т.е. явлении, при котором резко усиливаются катаболические процессы и происходит накопление недоокисленных продуктов.
Г. Шаде назвал ацидоз главной движущей силой воспаления, поскольку он мог лежать в основе практически всех компонентов этого типового патологического процесса. Было показано, что ацидоз изменяет тонус сосудов, повышает сосудистую проницаемость, что может приводить к нарушениям местного кровообращения. Накопление ионов Н+ è Ê+ на фоне увеличения проницаемости имеет отношение к развитию экссудации и воспалительного отека. Дренаж положительно заряженных ионов водорода и калия в венозные отделы микроциркуляторного русла изменяет заряд (дзета-потенциал) тромбоцитов и эритроцитов, что соответствует их агрегации с развитием явления сладжа и тромбоза, и венозной гиперемии, которая при прогрессировании может завершиться стазом.
Эти же факторы (накопление в тканях ионов Н+ è Ê+) могут обеспечивать электрокинетическое привлечение отрицательно заряженных лейкоцитов, т.е. стимулировать их эмиграцию в зону повреждения. Было известно также, что незначительный ацидоз способен усиливать активность клеток соединительной ткани (фибробластов) и тем самым стимулировать процесс пролиферации. Выраженный ацидоз оказывает бактерицидное действие по отношению к микроорганизмам, обеспечивая защитные реакции при бактериальном воспалении.
По современным представлениям, однако, ацидоз, играя существенную роль в развитии воспаления, все же не может считаться главным (или ведущим) его патогенетическим фактором. Было показано, что еще до развития ацидоза в зоне альтерации обнаруживаются субстанции, которые выступают в роли
91
медиаторов (посредников), обеспечивающих развитие воспалительной реакции. Одни из них имеют клеточное происхождение, прочие образуются в ходе развития воспалительной реакции из компонентов плазмы. По химической структуре выделяют три группы медиаторов:
1.Биогенные амины (гистамин, серотонин);
2.Белковой природы (комплемент, кинины);
3.Прочие, в том числе простагландины.
Инициальным фактором, обеспечивающим их появление, является повреждение лизосом. Эту закономерность иллюстрирует представленная схема.
92
4. Роль медиаторов и модуляторов в патогенезе воспаления
Как уже отмечалось, медиаторы и модуляторы – это обширная группа биологически активных веществ различной природы и происхождения, которым отводится важнейшая роль в развитии компонентов воспаления, что определяется их многообразными свойствами.
Клеточные медиаторы воспаления. Флогогенное повреждение тучных клеток соединительной ткани вызывает их дезинтеграцию и дегрануляцию, что сопровождается высвобождением из гранул биогенных аминов, в том числе гистамина. Он вызывает расширение мелких артериол, что сопровождается увеличением их проницаемости, вызывает чувство боли, повышает адгезивные свойства эндотелия сосудов; в больших концентрациях гистамин вызывает сокращение мелких вен. Когда в реакцию повреждения вовлекаются тромбоциты, из них высвобождается другой биогенный амин - серотонин, который в отношении проницаемости, тонуса вен вызывает сходный с гистамином эффект, а также способен вызвать чувство боли.
К эффектам гистамина в последующем подключаются биологически активные вещества нейтрофилов, эозинофилов и лимфоцитов, которые интенсивно мигрируют в зону воспаления из кровотока. В гранулах нейтрофилов содержатся гидролазы, лизоцим, катионные белки, щелочная фосфатаза, миелопероксидаза, лактоферрин, которые обладают антимикробным эффектом. Кроме того, мембраны этих клеток становятся источником еще одной группы медиаторов фосфолипидной природы, которые представлены простагландинами и лейкотриенами. Предшественником этих соединений является арахидоновая кислота, освобождающаяся из фосфолипидов клеточных мембран под действием лизосомальных ферментов поврежденных клеток. Под влиянием фермента циклооксигеназы запускается каскад превращений арахидоновой кислоты, в результате которых в очаге воспаления накапливаются простагландины разных классов и свойств. Под влиянием простагландинов группы Е проницаемость сосудов резко возрастает, и микрососуды расширяются. Напротив, простагландины группы F вызывают спазм микрососудов и уменьшение их проницаемости.
При втором пути окисления с участием липооксигеназы из арахидоновой кислоты образуются лейкотриены. Наиболее изучены такие лейкотриены как ЛТВ4 (обладает мощным хемотаксическим эффектом, вызывает адгезию нейтрофилов к эндотелиоцитам) ЛТС4, ËÒÄ4, ËÒÅ4 (вазоконстрикция, повышение проницаемости, отек, бронхоспазм). Некоторые из них усиливают агрегацию тромбоцитов. В свою очередь, в агрегатах тромбоцитов образуются новые медиаторы воспаления – серотонин, тромбоксан А2, простагландины Е.
Известно, что тромоксан А2 вызывает сужение сосудов, усиливает агрегацию тромбоцитов, тромбообразование, боль, отек. В неповрежденной сосудистой стенке биосинтез простагландинов происходит при участии простациклинсинтетазы с образованием простациклина (он же простагландин
93
I2 расширяет сосуды и тормозит агрегацию тромбоцитов). Если эндотелий сосудов поврежден и простациклинсинтетазы оказывается недостаточно, то в нем образуется большое количество тромбоксана А2, в результате чего стимулируется агрегация тромбоцитов и происходит спазм сосудов.
Таким образом, простациклины и лейкотриены разных классов оказывают противоположные эффекты (как стимулирующие, так и тормозящие развитие воспаления). Поэтому их стали называть модуляторами воспаления, т.е. субстанциями, которые способны изменять (модифицировать) действие истинных медиаторов. Например, некоторые из них, добавленные к раствору гистамина, вдвое усиливают его эффекты.
Лейкотриены и простагландины реализуют свои эффекты через системы внутриклеточных мессенджеров, к которым относятся цАМФ и цГМФ. Так, например, простагландин D2 повышает в клетках уровень цАМФ и, тормозя тем самым выброс медиаторов, ослабляет интенсивность воспалительной реакции. Другой простагландин F2a, повышая уровень цГМФ, усиливает выброс медиаторов и стимулирует воспаление.
По современным представлениям, указанные вещества фосфолипидной природы (эйкозаноиды) играют исключительно важную роль в патогенезе воспаления, осуществляя его регуляцию. В пользу такого заключения указывает, в частности, мощный противовоспалительный эффект при применении ингибиторов их синтеза.
К группе медиаторов клеточного происхождения относится также фактор активации тромбоцитов (ФАТ), ферменты (эластаза, коллагеназа), некоторые нейропептиды, освобождающиеся нервными волокнами при их повреждении. ФАТ, кроме усиления агрегации тромбоцитов, способствует выделению гистамина и серотонина, активирует процессы перекисного окисления липидов, резко увеличивает проницаемость сосудов. Эластаза и коллагеназа способствуют разрушению базальной мембраны сосудистой стенки и увеличению ее проницаемости.
Важная роль в развитии воспаления принадлежит еще одной группе веществ белкового происхождения – цитокинам (монокинам и лимфокинам). Их источником являются активированные моноциты и лимфоциты (хотя некоторые цитокины могут вырабатываться нейтрофилами и эндотелиоцитами). Наиболее изученным из цитокинов является интерлейкин–1 (ИЛ-1) и фактор некроза опухолей (ФНОa). Цитокины оказывают влияние на процессы, протекающие как в очаге воспаления, так и за его пределами. Они повышают проницаемость сосудов, усиливают адгезию, стимулируют эмиграцию и фагоцитоз лейкоцитов, стимулируют очищение, пролиферацию и дифференцировку клеток. Попадая в общую циркуляцию, они влияют на клетки вне зоны воспалительного очага (лимфоциты, синовиоциты, гепатоциты, клетки костного мозга, лимфоциты и нейроциты). Считается, что характерные для ранних этапов протекающих с воспалительным компонентом заболеваний такие симптомы как головная боль, мышечные боли, боли в суставах, сонливость, анорексия, лихорадка, увеличение иммуноглобулинов в плазме
94
крови являются системными эффектами цитокинов.
В последнее время установлено, что эндотелиоциты также способны синтезировать ИЛ-1, ФНОa, гамма-интерферон, гемопоэтические, ростовые факторы, во многом определяющие патогенез различных проявлений воспаления. Эндотелиоцитам отводят важную роль в процессах краевого стояния лейкоцитов, что связывают с секрецией ими так называемых молекул клеточной адгезии (селектины, интегрины, агрессины и некоторые другие).
Плазменные медиаторы воспаления. Эти медиаторы высвобождаются в процессе активации трех систем: кининовой, комплементарной и системы свертывания. Исходные компоненты данных систем находятся в крови в неактивном состоянии и приобретают свойства медиаторов при воспалении.
Первым активируется XII фактор свертывающей системы крови (фактор Хагемана). Это происходит при контакте с чужеродной поверхностью. Активный XII фактор запускает каскадный процесс внутренней системы гемокоагуляции. Образующийся при этом тромбин не только переводит фибриноген в фибрин, но и способствует адгезии нейтрофилов к эндотелию, стимулирует образование тромбоцитами ФАТ, продукцию эндотелием цитокинов.
Фактор Хагемана также стимулирует превращение прокалликреинов в калликреины. Среди кининов наиболее изучен брадикинин. Он усиливает местный кровоток, расширяет капилляры, повышает их проницаемость, вызывает боль. Кинины влияют на эмиграцию нейтрофилов, усиливают пролиферацию фибробластов, синтез коллагена и, таким образом, участвуют в репаративных процессах при воспалении. Кинины вызывают или усиливают высвобождение гистамина из тучных клеток, синтез простагландинов многими типами клеток. При их системном действии происходит генерализованное расширение сосудов, снижение артериального давления, бронхоспазм, брадикардия, асистолия.
Кроме кининов, фактор Хагемана активирует систему сывороточных белков системы комплемента. Включаясь в состав иммунных комплексов, факторы этой системы осуществляют лизис бактериальных клеток, обеспечивают реакции иммунного прилипания (опсонизация бактерий, вирусов), что делает их «узнаваемыми» для фагоцитов и стимулирует фагоцитоз. Среди различных белков, образующихся при активации системы комплемента, непосредственное отношение к воспалению имеют С5à, Ñ3à, Ñ3b и комплекс С5b-Ñ9. Последний отвечает за лизис микроорганизмов и патологически измененных клеток. Некоторые компоненты этой системы обладают хемотаксическим эффектом. Они способны высвобождать не только гистамин, но и медиаторы из нейтрофилов, стимулируют выделение простагландинов, лейкотриенов, ФАТ.
Кроме выше перечисленных веществ, к медиаторам воспаления относятся также ацетилхолин, катехоламины, гепарин. Они способны изменять тонус сосудов, их проницаемость и микротромбообразование, изменять
95
реологические свойства крови.
5.Нарушение периферического кровообращения
èмикроциркуляции при воспалении
Как уже упоминалось, характерная последовательность нарушения кровообращения была описана еще Ю.Конгеймом. Эти расстройства представляют собой 4 последовательно сменяющие друг друга стадии: кратковременный спазм микрососудов, стадию артериальной гиперемии, стадию венозной гиперемии и стаз.
Считается, что кратковременный спазм сосудов обусловлен: а) непосредственным действием повреждающего фактора на окончания сосудосуживающих нервов; б) выделением в момент повреждения гормонов надпочечников и освобождением норадреналина из структур, имеющих отношение к симпатической иннервации. Однако эффекты катехоламинов быстро прерываются в связи с действием моноамиоксидазы, концентрация которой увеличивается при повреждении тканей. Кроме того, сосудосуживающие эффекты катехоламинов могут перекрываться действием многих медиаторов, большинство из которых обладает сосудорасширяющим действием (гистамин, серотонин, кинины). Определенный вклад в расширение артериол вносит гипер-Н+-иония и гипер-К+-иония, а также паралич вазоконстрикторов.
Все эти факторы снимают спазм и, увеличивая просвет сосуда, способствуют развитию воспалительной артериальной гиперемии. Она сопровождается усилением кровотока, а клинически – покраснением тканей и локальным повышением температуры. В этот период в капиллярах увеличивается гидростатическое давление, возрастает лимфообращение и лимфообразование.
В отличие от других видов артериальной гиперемии, воспалительная имеет определенные особенности, которые, в конечном счете, трансформируют ее в венозную гиперемию. Как это понимать? Максимальное расширение артериол и капилляров создает относительную недостаточность объема отводящей части микроциркуляторного русла. Раннее и значительное повышение сосудистой проницаемости обеспечивает выход части белков и жидкой части крови в ткани, что приводит к формированию воспалительного отека и сгущению крови. Последнее увеличивает вязкость крови, т.е. ухудшает ее реологические свойства, что затрудняет венозный отток. Прогрессирующее развитие отека приводит к компрессии микрососудов и, прежде всего, венозного отдела микроциркуляторного русла, что также затрудняет венозный отток крови. Дренаж в венозные отделы ферментов, ионов водорода и калия вместе с повреждением элементов сосудистой стенки изменяет заряд клеток и активирует фактор Хагемана, что запускает механизмы сладжеобразования и микротромбооразования опять-таки в венозных отделах микроциркуляторного русла. Затруднение венозного оттока крови обеспечивает также краевое
96
стояние лейкоцитов, максимально выраженное в венулах. Венозная гиперемия сопровождается увеличением объема поврежденных тканей и развитием их цианоза.
По мере нарастания венозной гиперемии развивается нарушение поступательного движения крови, когда в момент систолы кровь в капиллярах движется в обычном направлении, а в момент диастолы – в обратном (маятникообразный кровоток), что далее заканчивается полным прекращением кровотока, т.е. стазом. Те же явления происходят и в лимфатическом отделе микроциркуляторного русла. Иначе говоря, в ходе развития воспаления, его очаг изолируется от других тканей, что ограничивает или даже предотвращает возможность попадания в общую циркуляцию токсических веществ тканевого и бактериального происхождения.
Однако расстройство кровообращения имеет и другой аспект. Венозная гиперемия и стаз, вызывая гипоксию тканей, способны обеспечить дальнейшее повреждение тканевых структур, т.е. способны усилить альтерацию. По современным представлениям вторичная альтерация зависит также от повреждающего действия протеаз, активных радикалов кислорода, активных компонентов комплемента, т.е. связана не только с явлениями циркуляторной гипоксии.
6. Экссудация и эмиграция
По мере развития нарушений местного кровообращения развиваются экссудация и эмиграция. Под экссудацией понимают выход из сосудов в окружающие ткани белоксодержащей жидкости, что приводит к развитию воспалительного отека. Этот процесс обусловлен следующими факторами:
·Повышением проницаемости сосудистой стенки;
·Повышением в стадию артериальной гиперемии гидростатического давления в артериальном конце капилляра;
·Повышением в стадию венозной гиперемии гидростатического давления в венозном конце капилляра, что ограничивает резорбцию тканевой жидкости в сосуды.
Способствует развитию экссудации гиперкалийиония и гиперонкия тканей при их воспалении, а также относительная и абсолютная недостаточность лимфооттока.
Показано также, что вода может перемещаться из сосудистого русла через поры в эндотелиоцитах, а также способом микропиноцитоза, когда происходит захватывание эндотелиоцитом мельчайших капелек жидкости, транспортировка их через цитоплазму с выходом в межтканевое пространство. При воспалении данный процесс усиливается.
Экссудаты различаются по содержанию белка, слизи, количеству клеток и их типам. С указанных позиций их подразделяют на серозный, фибринозный, гнойный, геморрагический.
Значение экссудации двойственное (защитно-приспособительное и
97
собственно патологическое). Защитно-приспособительная роль состоит в том что:
1.Обеспечивается доставка в ткани плазменных медиаторов, в том числе компонентов комплемента, кининов, факторов свертыващей системы и др. Они важны для стимуляции фагоцитоза и лизиса микроорганизмов, раневого очищения и стимуляции восстановительных процессов.
2.Фибриноген, попадающий в ткани, способен трансформироваться в фибрин, который обтурирует межклеточные промежутки и микрососуды, что изолирует в сосудистом отношении очаг воспаления и препятствует распространению токсических продуктов распада клеток и токсинов микроорганизмов.
3.Экссудат, накапливаясь в тканях, снижает концентрацию агрессивных продуктов распада тканей и тем самым ограничивает их повреждающие эффекты.
4.Экссудация способствует и эмиграции лейкоцитов, с функцией которых связаны защитные реакции при воспалении.
Однако экссудация имеет отношение к развитию венозной гиперемии и стаза, а значит может стимулировать процессы альтерации. Она же может стать источником тяжелейших расстройств, если речь идет о воспалительном отеке ткани мозга, гортани, легких, среднего уха.
Эмиграция - выход лейкоцитов через сосудистую стенку в ткани с перемещением их к эпицентру очага воспаления. Значение этого явления стало понятно с открытием И.И. Мечниковым фагоцитоза, т.е. процесса поглощения и переваривания клеткой различных частиц, которые являются или становятся чужеродными для организма при повреждении. И.И. Мечниковым было доказано, что фагоцитоз является одним из основных механизмов воспалительной реакции и направлен на уничтожение ее причинного фактора. Он разработал представление о хемотаксисе лейкоцитов, т.е. об их движении, обусловленном химическим раздражением. Многие вещества, в том числе и медиаторы воспалительного очага, воспринимаются лейкоцитами, и они активно реагируют на них перемещением по градиенту концентрации. Это главный механизм эмиграции. Вторым механизмом является электротаксис, когда отрицательно заряженные лейкоциты привлекаются электрокинетическими силами в зону очага, где скапливаются положительные ионы (заряды) преимущественно водорода и калия.
Среди различных факторов, участвующих в первом этапе эмиграции (краевом стоянии или марганации лейкоцитов) важную роль играют молекулы адгезии разных классов. Они выделяются из клеток на поверхность мембраны эндотелиоцитов таким образом, что первыми занимают краевое положение и оказываются в очаге воспаления гранулоциты. Позднее в эти процессы вовлекаются моноциты и лимфоциты. Подобная закономерность носит название правила миграции И.И.Мечникова.
98
Фагоцитоз совершается в несколько стадий:
1.Приближение к объекту;
2.Прилипание к объекту фагоцитоза;
3.Погружение объекта;
4.Внутриклеточное переваривание (происходит в фаголизосоме). Известно, что жизнеспособные объекты не перевариваются фагоцитами,
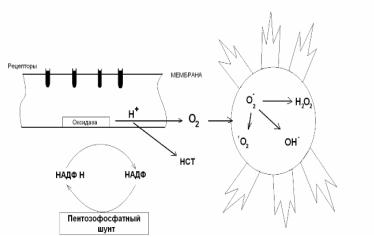
а, следовательно, объект фагоцитоза должен быть убит. Эта киллерная (бактерицидная) функция осуществляется особым набором факторов (катионные белки, миелопероксидаза, лактоферрин, лизоцим). Действие этих факторов многократно усиливается за счет способности лейкоцитов нарабатывать активные формы кислорода – супероксидный анионрадикал, синглетный кислород и др. Эти субстанции вызывают реакции перекисного окисления липидов, белков, нуклеиновых кислот, что сопровождается нарушением, как мембран, так и клеточных структур.
Образование радикалов происходит на фоне резкого (в 10-20 раз) увеличения поглощения фагоцитами кислорода, что получило название «респираторного взрыва». Этот поглощенный кислород активируется водородом, источником которого в фагоците является НАДФ.Í+. В результате этого образуются перекись водорода и активные кислородные радикалы. Таким образом, роль активных форм кислорода состоит в повышении бактерицидной способности фагоцитов (схема 2).
2
« »
99
Становится понятным, что наследственная или приобретенная недостаточность защитных систем лейкоцитов, как и действие флогогенных факторов на фоне лейкопении, обычно сопровождается максимальным развитием воспаления. Это сопровождается развитием вялотекущего процесса (хронизацией воспаления), что снижает его защитно-приспособительную функцию. Например, при агранулоцитозе (резкая лейкопения за счет гранулоцитов), воспаление проявляется развитием в тканях у пациентов язвенно-некротических процессов при минимальных воспалительных изменениях, что обычно сопровождается высокой летальностью.
Выходящие в ткани моноциты (тканевые макрофаги) обладают бактерицидными факторами, сходными с нейтрофильными. Но они играют роль в фагоцитозе преимущественно погибших клеток (в том числе тех же нейтрофилов). Кроме того, они выделяют цитокины и некоторые белки, способные «гасить» интенсивность воспалительных изменений и тем самым индуцировать завершающий этап воспаления – пролиферацию и репарацию. Отметим также, что макрофаги выделяют такие цитокины, которые стимулируют реакцию лимфоцитов на антигены, а также митогены, индуцирующие пролиферацию фибробластов.
7. Пролиферация и завершение процесс воспаления
Стадия пролиферации при воспалении характеризуется усилением деления клеток соединительной ткани. Как уже отмечалось, пролиферация этих клеток обнаруживается уже на ранних этапах воспаления и достигает максимума по мере очищения очага. В фазу альтерации она ограничивает избыточное распространение повреждения. В фазу сосудистых расстройств – ограничивает распространение очага воспаления, а далее – замещает и восполняет дефект ткани. Источником процессов пролиферации являются клетки соединительной ткани и паренхимы органов.
Непосредственно пролиферации предшествует выход в очаг воспаления фибриногена и образование фибрина, которые образуют матрицу для последующего гистогенеза. Затем в структуре этой фибриновой сеточки быстро распределяются фибробласты, появляются капилляры. Эти процессы проходят под контролем местных и общих факторов, которые могут как стимулировать, так и тормозить пролиферацию. К активаторам размножения фибробластов относят специфические белки, источниками которых могут быть разные клетки. Активированные тромбоциты выделяют тромбоцитарный фактор роста. Он также может секретироваться эндотелиальными клетками и самими фибробластами. В лимфоцитах также образуется пептид, стимулирующий соединительную ткань, а в моноцитах ИЛ-1. Стимулирующее влияние оказывает фактор роста фибробластов гипофиза, а в печени – соматомедин.
Размножение клеток в необходимых масштабах определяется не только стимуляторами, но ингибиторами пролиферации, примером которых являются
100
