
- •1.Исторический обзор развития термодинамики и статистической физики.
- •2.Простые модельные системы. Конфигурации. Макросостояние и микросостояние системы. Однородное и неоднородное состояние системы
- •3.Распределение вероятностей для случайной физической величины. Теоремы сложения и умножения вероятностей.
- •4. Понятие вероятности. Статистическая независимость и квадратичная флуктуация
- •5.Равновесное и неравновесное состояния системы. Флуктуации. Необратимость. Энтропия.
- •6.Классическое описание движения механических систем. Канонические уравнения движения гамильтона
- •7.Фазовое пространство. Точка фазового пространства. Объем фазового пространства. Фазовая траектория. Статистический ансамбль.
- •8.Теорема лиувилля. Функция статистического распределения
- •11. Распределение Максвелла
- •12. Распределение Максвелла-Больцмана
- •13.Микроканонический ансамбль.
- •17. Уравнение состояния идеального газа
- •18. Одноатомный идеальный газ.
- •19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
- •20.Классическая теория теплоемкости многоатомного идеального газа.
- •23.25. Квантово-механическое описание систем. У.Ш. Рассчет числа возможных состояний ид.Газа.
- •29.21 Теплоемкость твердых тел. Теория эйнштейна.
- •30. Теплоемкость твердых тел. Теория Дебая.
- •31. Теория флуктуаций
- •32.Термодинамическая система. Равновесные состояния и равновесные процессы. Температура. Нулевое начало.
- •33.Изопроцессы. Работа.
- •35. Теплоемкость газа.
- •36. Круговые процессы. Цикл Карно.
- •38. Процесс джоуля-томсона
- •40. Второе начало термодинамики.
- •41.Энтропия. З-н возраст.Э-пии
- •42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
- •43. Третье начало термод. И его следствия
- •44.Системы с переменным количеством вещества. Химический потенциал.
- •45.Равновесие фаз. Фазовые переходы первого рода
- •47. Броуновское движение. Уравнение фоккера-планка
- •48. Фазовые переходы второго рода. Теория ландау
- •51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
- •52. Каноническое распределение и термодин. Функции.
17. Уравнение состояния идеального газа
Уравнение состояния - уравнение, связывающее между собой термодинамические (макроскопические) параметры системы, такие, как температура, давление, объём, химический потенциал и др. Уравнение состояния можно написать всегда, когда можно применять термодинамическое описание явлений. При этом реальные уравнения состояний реальных веществ могут быть крайне сложными. Уравнение состояния системы не содержится в постулатах термодинамики и не может быть выведено из неё. Оно должно быть взято со стороны (из опыта или из модели, созданной в рамках статистической физики). Термодинамика же не рассматривает вопросы внутреннего устройства вещества. Заметим, что соотношения, задаваемые уравнением состояния, справедливы только для состояний термодинамического равновесия. Идеальным наз. газ, уравнение состояния которого имеет вид: pV=vRT
его называют уравнением Клапейрона. Здесь v — количество вещества, измеряемое числом молей, R — универсальная газовая постоянная: R = 8,314 Дж/(моль*К). Моль — это количество вещества, содержащее число частиц, равное постоянной Авогадро: Na=6.022*10^23 моль^(-1). Молю соответствует масса — молярная масса, — разная для различных газов. С молекулярной точки зрения идеальный газ состоит из молекул, взаимодействие между которыми пренебрежимо мало. Это присуще всем газам при достаточно большом разряжении. Простота модели идеального газа делает ее наиболее подходящей для ознакомления с методами изучения макросистем и с соответствующими понятиями.
18. Одноатомный идеальный газ.
Согласно
МКТ на 1-у степень свободы приходится
энергия =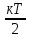 ,
где к – постоянная Больцмана, а Т –
абсолютная температура. Однаатомный
газ имеет 3 степени свободы. Тогда
внутренняя энергия:
,
где к – постоянная Больцмана, а Т –
абсолютная температура. Однаатомный
газ имеет 3 степени свободы. Тогда
внутренняя энергия: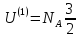 kT=
kT=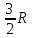 T,
T,
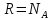 k
k
19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
Модель гантель.
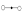
3-степени свободы, и 2 вращательные степени свободы, т.е. полное число – 5 степеней свободы.
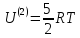 ,
,
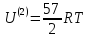
20.Классическая теория теплоемкости многоатомного идеального газа.
Основным
отличием не одноатомных газов от
одноатомных является наличие у них
вращательных и колебательных степеней
свободы. Считаем, что молекулы – это
классические системы, подчиняющиеся
законам Ньютона. Если молекулы газа не
находятся во внешнем поле, то энергия
их будет равна сумме энергии поступательного,
вращательного и колебательного движений.
Поступательное движение многоатомных
молекул ничем не отличается от
поступательного движения одноатомных
молекул, поскольку оно сводится к
движению центра тяжести системы.Для
вращательного движения также оказывается,
что на каждую степень свободы приходится
энергия kT\2.
Лишь при рассмотрении малых колебаний
атомов в молекуле около равновесного
расстояния между ними получается, что
на одну колебательную степень свободы
приходится в среднем энергия, вдвое
большая, чем на одну степень свободы
поступательного или вращательного
движений. Смысл этого станет понятным,
если вспомнить, что при колебательном
движении средняя (за период) кинетическая
энергия системы равна средней потенциальной
энергии. Энергия колебательного движения
состоит из 2-х слагаемых, имеющих
одинаковую структуру квадратичного
выражения относительно скоростей
(импульсов) и координат. Для остальных
степеней свободы (поступательное,
вращательное движение) энергия выражается
одним квадратичным (пропорциональным
квадрату линейной или угловой скорости)
членом на каждую степень свободы.
Усреднение каждого квадратичного
слагаемого в энергии колебаний приводит
к средней энергии kT\2+kT\2=kT
Таким образом, оказывается, что все
степени свободы молекулы являются
равноправными: каждое квадратичное
слагаемое в энергии дает вклад в среднюю
энергию молекулы, равный kT\2
(закон равномерного распределения по
степеням свободы).Если в идеальном газе
имеется N
молекул, то средняя энергия газов равна
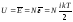 i
- общее число степеней свободы молекулы.А
молярная теплоемкость
i
- общее число степеней свободы молекулы.А
молярная теплоемкость
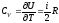 Таким образом, теплоемкость идеальных
газов оказывается не зависящей от
температуры и определяется исключительно
структурой молекулы - числом степеней
свободы ее.Для одноатомных газов
предсказания теории хорошо оправдываются
на опыте. Но уже для 2-х атомных газов
это не так; теплоемкость 2-х атомных
газов должна быть равнаCv=7\2R
Опыт показывает, что такой большой
теплоемкостью они не обладают. Кроме
того, оказывается, что теплоемкость 2-х
атомных газов зависит от температуры.
С понижением температуры она падает и
стремится к значению 5\2R-это
значение имел бы газ, состоящий из
молекул с жесткими связями между атомами,
при которых колебания атомов невозможны.
Такое исчезновение колебательного
движения, с точки зрения классической
механики, является совершенно
необъяснимым..Таким образом, опыт
показывает, что закон равномерного
распределения энергии по степеням
свободы, который в частности основан
на применимости представлений классической
механики, выполняется только при высоких
температурах
Таким образом, теплоемкость идеальных
газов оказывается не зависящей от
температуры и определяется исключительно
структурой молекулы - числом степеней
свободы ее.Для одноатомных газов
предсказания теории хорошо оправдываются
на опыте. Но уже для 2-х атомных газов
это не так; теплоемкость 2-х атомных
газов должна быть равнаCv=7\2R
Опыт показывает, что такой большой
теплоемкостью они не обладают. Кроме
того, оказывается, что теплоемкость 2-х
атомных газов зависит от температуры.
С понижением температуры она падает и
стремится к значению 5\2R-это
значение имел бы газ, состоящий из
молекул с жесткими связями между атомами,
при которых колебания атомов невозможны.
Такое исчезновение колебательного
движения, с точки зрения классической
механики, является совершенно
необъяснимым..Таким образом, опыт
показывает, что закон равномерного
распределения энергии по степеням
свободы, который в частности основан
на применимости представлений классической
механики, выполняется только при высоких
температурах
22. Неидеальный одноатомный газ. Вычисление статистического интеграла. Важное достижение С. ф. — вычисление поправок к термодинамическим величинам газа, связанных с взаимодействием между его частицами. С этой точки зрения уравнение состояния идеального газа является первым членом разложения давления реального газа по степеням плотности числа частиц, поскольку всякий газ при достаточно малой плотности ведёт себя как идеальный. С повышением плотности начинают играть роль поправки к уравнению состояния, связанные с взаимодействием. Они приводят к появлению в выражении для давления членов с более высокими степенями плотности числа частиц, так что давление изображается т. н. вириальным рядом вида:
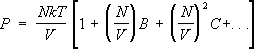 .
(15)
.
(15)
Коэффициенты В, С и т.д. зависят от температуры и наываются. вторым, третьим и т.д. вириальными коэффициентами. Методы С. ф. позволяют вычислить эти коэффициенты, если известен закон взаимодействия между молекулами газа. При этом коэффициенты В, С,... описывают одновременное взаимодействие двух, трёх и большего числа молекул. Например, если газ одноатомный и потенциальная энергия взаимодействия его атомов U (r), то второй вириальный коэффициент равен
![]() .
(16)
.
(16)
По
порядку величины В
равен
![]() ,
гдеr0
— характерный размер атома, или, точнее,
радиус действия межатомных сил. Это
означает, что ряд (15) фактически
представляет собой разложение по
степеням безразмерного параметра Nr3/V,
малого для достаточно разреженного
газа. Взаимодействие между атомами газа
носит характер отталкивания на близких
расстояниях и притяжения на далёких.
Это приводит к тому, что В
> 0 при высоких температурах и В
< 0 при низких. Поэтому давление реального
газа при высоких температурах больше
давления идеального газа той же плотности,
а при низких — меньше. Так, например,
для гелия при Т
= 15,3 К коэффициент В
= —3×10-23
см3,
а при T
= 510 К В
= 1,8 ×10-23
см3.
Для аргона В
= —7,1×10-23
см3
при Т =
180 К и В
= 4,2×10-23
см3
при Т
= 6000 К. Для одноатомных газов вычислены
значения вириальных коэффициентов,
включая пятый, что позволяет описывать
поведение газов в достаточно широком
интервале плотностей (см. также Газы).
,
гдеr0
— характерный размер атома, или, точнее,
радиус действия межатомных сил. Это
означает, что ряд (15) фактически
представляет собой разложение по
степеням безразмерного параметра Nr3/V,
малого для достаточно разреженного
газа. Взаимодействие между атомами газа
носит характер отталкивания на близких
расстояниях и притяжения на далёких.
Это приводит к тому, что В
> 0 при высоких температурах и В
< 0 при низких. Поэтому давление реального
газа при высоких температурах больше
давления идеального газа той же плотности,
а при низких — меньше. Так, например,
для гелия при Т
= 15,3 К коэффициент В
= —3×10-23
см3,
а при T
= 510 К В
= 1,8 ×10-23
см3.
Для аргона В
= —7,1×10-23
см3
при Т =
180 К и В
= 4,2×10-23
см3
при Т
= 6000 К. Для одноатомных газов вычислены
значения вириальных коэффициентов,
включая пятый, что позволяет описывать
поведение газов в достаточно широком
интервале плотностей (см. также Газы).
