
- •1.Исторический обзор развития термодинамики и статистической физики.
- •2.Простые модельные системы. Конфигурации. Макросостояние и микросостояние системы. Однородное и неоднородное состояние системы
- •3.Распределение вероятностей для случайной физической величины. Теоремы сложения и умножения вероятностей.
- •4. Понятие вероятности. Статистическая независимость и квадратичная флуктуация
- •5.Равновесное и неравновесное состояния системы. Флуктуации. Необратимость. Энтропия.
- •6.Классическое описание движения механических систем. Канонические уравнения движения гамильтона
- •7.Фазовое пространство. Точка фазового пространства. Объем фазового пространства. Фазовая траектория. Статистический ансамбль.
- •8.Теорема лиувилля. Функция статистического распределения
- •11. Распределение Максвелла
- •12. Распределение Максвелла-Больцмана
- •13.Микроканонический ансамбль.
- •17. Уравнение состояния идеального газа
- •18. Одноатомный идеальный газ.
- •19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
- •20.Классическая теория теплоемкости многоатомного идеального газа.
- •23.25. Квантово-механическое описание систем. У.Ш. Рассчет числа возможных состояний ид.Газа.
- •29.21 Теплоемкость твердых тел. Теория эйнштейна.
- •30. Теплоемкость твердых тел. Теория Дебая.
- •31. Теория флуктуаций
- •32.Термодинамическая система. Равновесные состояния и равновесные процессы. Температура. Нулевое начало.
- •33.Изопроцессы. Работа.
- •35. Теплоемкость газа.
- •36. Круговые процессы. Цикл Карно.
- •38. Процесс джоуля-томсона
- •40. Второе начало термодинамики.
- •41.Энтропия. З-н возраст.Э-пии
- •42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
- •43. Третье начало термод. И его следствия
- •44.Системы с переменным количеством вещества. Химический потенциал.
- •45.Равновесие фаз. Фазовые переходы первого рода
- •47. Броуновское движение. Уравнение фоккера-планка
- •48. Фазовые переходы второго рода. Теория ландау
- •51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
- •52. Каноническое распределение и термодин. Функции.
43. Третье начало термод. И его следствия
Новым
фундаментальным законом, открытым
Нернстом эмпирическим путем явл. тепловая
т. Нернста. Т.
Нернста не может быть логически выведена
из остальных начал термодинамики, а
потому ее называют третьим
началом термодинамики.
Содержание
т. Нернста сводится к двум утверждениям.
Первое: при
приближении к абс. нулю энтропия стремится
к определенному конечному пределу.
Поэтому
имеет смысл говорить об энтропии
тела при абсолютном нуле температур.
Термод.
определение энтропии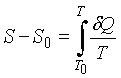 .
.
Первая часть т. Нернста как раз и состоит в утверждении, что интеграл сходится. Вторая часть утверждает, что все процессы при абсолютном нуле температур, переводящие систему из одного равновесного состояния в другое равновесное состояние, происходят без изменения энтропии. Из этого утверждения следует, что предел, к которому стремится интеграл при Т->0 , не зависит от того, в каком конечном состоянии окажется система. Т.о. можно дать т. Нернста формулируется: при приближении к абсолютному нулю приращение энтропии S-S0 стремится к вполне определенному конечному пределу, не зависящему от значений, которые принимают все параметры, характеризующие состояние системы (p,V, агрегатного состояния).Т. Нернста относится только к термодин. равновесным состояниям систем. Рассмотрим следствия т. Нернста: Из первой части т. Нернста следует, что при приближении к абсолютному нулю теплоемкости СР и Cv всех тел должны стремиться к нулю. В самом деле, допустим, например, что давление остается постоянным. Тогда δQ = СРdT. Теорема Нернста требует, чтобы интеграл сходился. Но это было бы невозможно, если бы при Т=0 теплоемкость СР не обращалась в нуль. Аналогично теплоемкость Сv должна вести себя так же.
Полученные
следствия доказывают, что теплоемкости
вещества обязательно должны зависеть
от температуры. Классическая теория
теплоемкостей приводит к противоположному
выводу о независимости теплоемкости
от температуры. Cледствия
из второй части теоремы Нернста.
Воспользуемся термодинамическими
соотношениями
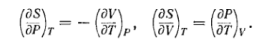 Из т. Нернста следует, что при абсолютном
нуле левые части этих соотношений
обращаются в нуль. Должны быть равны
нулю и правые части, а потому
Из т. Нернста следует, что при абсолютном
нуле левые части этих соотношений
обращаются в нуль. Должны быть равны
нулю и правые части, а потому![]()
![]() Это значит, чтопри
приближении к абсолютному нулю для всех
тел должны стремиться к нулю коэффициент
теплового расширения и термический
коэффициент давления.
Это значит, чтопри
приближении к абсолютному нулю для всех
тел должны стремиться к нулю коэффициент
теплового расширения и термический
коэффициент давления.
44.Системы с переменным количеством вещества. Химический потенциал.
Химический потенциал μ - один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде dE=TdS-PdV+ μdN. Химический потенциал (μ) компонента определяется как энергия, которую необходимо затратить для того, чтобы добавить в систему бесконечно малое молярное количество dN этого компонента. Тогда выражения для дифференциалов термодинамических потенциалов могут быть записаны так: dU=TdS-pdV+ μdN; dI=TdS+VdP +μdN; dF=-SdT-pdV+ μdN; dG=-SdT+Vdp+ μdN. Поскольку термодинамические потенциалы должны быть аддитивными функциями числа частиц в системе, канонические уравнения состояния принимают такой вид (с учётом того, что S и V аддитивные величины, а T и P нет):
U=U(S,V,N)=N*f(S\N,V\N)=N*Um;I=I(S,p,N)=N*I(S\N,p)=N*Im,F=F(V,T,N)=N*f(V\N,T)=N*Fm;G=G(p,T,N)=N*f(p,T)=N*Gm;
Так как
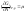 ,
тоG=N*μ,
то есть химический потенциал — это
удельный потенциал Гиббса (на одну
частицу). Если в системе имеется несколько
разных типов частиц, есть столько же
разных химических потенциалов.
,
тоG=N*μ,
то есть химический потенциал — это
удельный потенциал Гиббса (на одну
частицу). Если в системе имеется несколько
разных типов частиц, есть столько же
разных химических потенциалов.
