
- •1.Исторический обзор развития термодинамики и статистической физики.
- •2.Простые модельные системы. Конфигурации. Макросостояние и микросостояние системы. Однородное и неоднородное состояние системы
- •3.Распределение вероятностей для случайной физической величины. Теоремы сложения и умножения вероятностей.
- •4. Понятие вероятности. Статистическая независимость и квадратичная флуктуация
- •5.Равновесное и неравновесное состояния системы. Флуктуации. Необратимость. Энтропия.
- •6.Классическое описание движения механических систем. Канонические уравнения движения гамильтона
- •7.Фазовое пространство. Точка фазового пространства. Объем фазового пространства. Фазовая траектория. Статистический ансамбль.
- •8.Теорема лиувилля. Функция статистического распределения
- •11. Распределение Максвелла
- •12. Распределение Максвелла-Больцмана
- •13.Микроканонический ансамбль.
- •17. Уравнение состояния идеального газа
- •18. Одноатомный идеальный газ.
- •19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
- •20.Классическая теория теплоемкости многоатомного идеального газа.
- •23.25. Квантово-механическое описание систем. У.Ш. Рассчет числа возможных состояний ид.Газа.
- •29.21 Теплоемкость твердых тел. Теория эйнштейна.
- •30. Теплоемкость твердых тел. Теория Дебая.
- •31. Теория флуктуаций
- •32.Термодинамическая система. Равновесные состояния и равновесные процессы. Температура. Нулевое начало.
- •33.Изопроцессы. Работа.
- •35. Теплоемкость газа.
- •36. Круговые процессы. Цикл Карно.
- •38. Процесс джоуля-томсона
- •40. Второе начало термодинамики.
- •41.Энтропия. З-н возраст.Э-пии
- •42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
- •43. Третье начало термод. И его следствия
- •44.Системы с переменным количеством вещества. Химический потенциал.
- •45.Равновесие фаз. Фазовые переходы первого рода
- •47. Броуновское движение. Уравнение фоккера-планка
- •48. Фазовые переходы второго рода. Теория ландау
- •51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
- •52. Каноническое распределение и термодин. Функции.
45.Равновесие фаз. Фазовые переходы первого рода
Фазой
называется макроскопическая физически
однородная теть вещества, отделенная
от остальных частей системы границами
раздела, так что она может быть извлечена
из системы механическим путем.
Важнейшим
вопросом является выяснение условий,
при которых система, состоящая из двух
или нескольких фаз, находится в равновесии.
Это
включает в себя механическое
и
тепловое
равновесия. Для
теплового равновесия необходимо, чтобы
все фазы системы имели одну и ту же
температуру. Необходимым условием
механического равновесия является
равенство давлений по разные стороны
границы раздела соприкасающихся фаз.
Равенство давлений и температур не
означает, что система находится в
равновесии, так как соприкасающиеся
фазы могут превращаться друг в друга.
Такие превращения называются фазовыми
превращениями. При
фазовых превращениях одни фазы растут,
другие уменьшаются и даже могут совсем
исчезнуть. Состояние равновесия
характеризуется тем, что массы всех фаз
системы остаются неизменными.
Следовательно, должно быть выполнено
еще одно необходимое условие равновесия
- равновесие
по отношению к взаимным превращениям
фаз.
Примерами фазовых превращений могут
служить изменения агрегатного
состояния вещества.Вообще,
фазовое
равновесие между любыми фазами 1 и 2
не есть статическое состояние, в котором
полностью прекратились фазовые
превращения, а характеризуется
равенством средних скоростей двух
взаимно противоположных процессов:
превращения фазы 1 в фазу 2 и обратного
превращения фазы 2 в фазу.
Фазовые
превращения, при которых первые
производные функции G(T,p)
меняются скачкообразно, называются
фазовыми превращениями первого рода.
Фазовые переходы первого рода
сопровождаются теплотой перехода.
Фазовые переходы первого рода описываются
уравнением Клапейрона-Клаузиуса
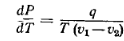 q-
удельная теплота фазового перехода, v1
и v2
– удельные объемы фазы 1 и фазы 2.
q-
удельная теплота фазового перехода, v1
и v2
– удельные объемы фазы 1 и фазы 2.
46. Термодинамика газа Ван-дер-Ваальса. Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь междудавлением,объёмомитемпературой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
![]() отенциальная
энергия межмолекулярных сил взаимодействия
вычисляется как работа, которую совершают
эти силы, при разведении молекул на
бесконечность:
отенциальная
энергия межмолекулярных сил взаимодействия
вычисляется как работа, которую совершают
эти силы, при разведении молекул на
бесконечность:
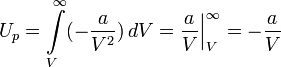 Внутренняя
энергия
газа Ван-дер-Ваальса складывается из
его кинетической энергии (энергии
теплового движения молекул) и только
что нами посчитанной потенциальной.
Так, для одного моль газа:
Внутренняя
энергия
газа Ван-дер-Ваальса складывается из
его кинетической энергии (энергии
теплового движения молекул) и только
что нами посчитанной потенциальной.
Так, для одного моль газа:
![]() где
где
![]() —молярная
теплоёмкость
при постоянном объёме, которая
предполагается не зависящей от
температуры.Критическими параметрами
газа называются значения его макропараметров
(давления, объёма и температуры) в
критической
точке,
т.е. в таком состоянии, когда жидкая и
газообразная фазы вещества неразличимы.
Найдем эти параметры для газа
Ван-дер-Ваальса, для чего преобразуем
уравнение состояния:
—молярная
теплоёмкость
при постоянном объёме, которая
предполагается не зависящей от
температуры.Критическими параметрами
газа называются значения его макропараметров
(давления, объёма и температуры) в
критической
точке,
т.е. в таком состоянии, когда жидкая и
газообразная фазы вещества неразличимы.
Найдем эти параметры для газа
Ван-дер-Ваальса, для чего преобразуем
уравнение состояния:
![]()
![]() Мы
получили уравнение третьей степени
относительно
Мы
получили уравнение третьей степени
относительно
![]() .
.
![]() В
критической точке все три корня уравнения
сливаются в один, поэтому предыдущее
уравнение эквивалентно следующему:
В
критической точке все три корня уравнения
сливаются в один, поэтому предыдущее
уравнение эквивалентно следующему:
![]()
![]() Приравняв
коэффициенты при соответствующих
степенях
Приравняв
коэффициенты при соответствующих
степенях
![]() ,
получим равенства:
,
получим равенства:
![]()
![]()
![]()
Из них вычислим значения критических параметров...
![]()
![]()
![]()
...и критического коэффициента:
![]()
