
- •1.Исторический обзор развития термодинамики и статистической физики.
- •2.Простые модельные системы. Конфигурации. Макросостояние и микросостояние системы. Однородное и неоднородное состояние системы
- •3.Распределение вероятностей для случайной физической величины. Теоремы сложения и умножения вероятностей.
- •4. Понятие вероятности. Статистическая независимость и квадратичная флуктуация
- •5.Равновесное и неравновесное состояния системы. Флуктуации. Необратимость. Энтропия.
- •6.Классическое описание движения механических систем. Канонические уравнения движения гамильтона
- •7.Фазовое пространство. Точка фазового пространства. Объем фазового пространства. Фазовая траектория. Статистический ансамбль.
- •8.Теорема лиувилля. Функция статистического распределения
- •11. Распределение Максвелла
- •12. Распределение Максвелла-Больцмана
- •13.Микроканонический ансамбль.
- •17. Уравнение состояния идеального газа
- •18. Одноатомный идеальный газ.
- •19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
- •20.Классическая теория теплоемкости многоатомного идеального газа.
- •23.25. Квантово-механическое описание систем. У.Ш. Рассчет числа возможных состояний ид.Газа.
- •29.21 Теплоемкость твердых тел. Теория эйнштейна.
- •30. Теплоемкость твердых тел. Теория Дебая.
- •31. Теория флуктуаций
- •32.Термодинамическая система. Равновесные состояния и равновесные процессы. Температура. Нулевое начало.
- •33.Изопроцессы. Работа.
- •35. Теплоемкость газа.
- •36. Круговые процессы. Цикл Карно.
- •38. Процесс джоуля-томсона
- •40. Второе начало термодинамики.
- •41.Энтропия. З-н возраст.Э-пии
- •42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
- •43. Третье начало термод. И его следствия
- •44.Системы с переменным количеством вещества. Химический потенциал.
- •45.Равновесие фаз. Фазовые переходы первого рода
- •47. Броуновское движение. Уравнение фоккера-планка
- •48. Фазовые переходы второго рода. Теория ландау
- •51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
- •52. Каноническое распределение и термодин. Функции.
41.Энтропия. З-н возраст.Э-пии
Второе
начало установлено опытным путем..
Второе начало вводит новую функцию
состояния - энтропию
S,
изменение которой для обратимых
равновесных процессов равно приведенному
теплу 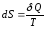
Как мы знаем, δQ не есть приращение какой-то функции, но после деления на температуру Т, оказывается, получается приращение некоторой функции (энтропии). В отличие от теплоты, энтропия такая же функция состояния как температура, внутренняя энергия или давление.
2. Энтропия - величина аддитивная: энтропия макросистемы равна сумме энтропии ее отдельных частей. 3. Одно из важнейших свойств энтропии заключается в том» что энтропия замкнутой (т.е. теплоизолированной) макросистемы не уменьшается - она либо возрастает, либо остается постоянной. Принцип возрастания энтропии замкнутых систем представляет собой еще одну формулировку второго начала термод-ки. Величина возрастания энтропии в замкнутой макросис-ме может служить мерой необратимости процессов, протекающих в системе. В предельном случае, когда процессы имеют обратимый характер, энтропия замкнутой макросистемы не меняется. Принцип возрастания энтропии со статистической точки зрения привел Больцмана к фундаментальному выводу: все замкнутые макросистемы стремятся переходить от состояний менее вероятных к более вероятным.
При этом сама энтропия S характеризует степень беспорядка в макросистеме: состояниям с большим беспорядком отвечает большая вероятность (или статистический вес ), чем у более упорядоченного состояния. S=kLn
42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
Второе
начало установлено опытным путем..
Второе начало вводит новую функцию
состояния - энтропию
S,
изменение которой для обратимых
равновесных процессов равно приведенному
теплу 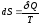
Для
произвольного (не квазиравновесного)
процесса верно следующее неравенство
Клаузиуса:
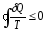
Термодинамич.
равновесие — состояние изолированной
термодинамической системы, при котором
в каждой точке для всех химических,
диффузионных, ядерных, и других процессов
скорость прямой реакции равна скорости
обратной. Исследование свойства энтропии
даёт важное общее условие равновесия
в изолированной системе - условие
максимума энтропии. Максимум достигается,
когда завершаются односторонние
неравновесные процессы и система
переходит в равновесное, наиболее
вероятное состояние. В приложениях
термодинамики к конкретным вопросам
часто удобны два критерия. - Пусть
система окружена средой, температура
которой поддерживается постоянной.
Кроме того, объем системы V
также
поддерживается постоянным. В этих
условиях работа системы А
всегда
равна нулю. Если температура
окружающей среды Т и объем системы V
поддерживаются постоянными и в
рассматриваемом состоянии потенциал
Гельмгольца F=U-TS
(изохорно-изотермич. потенциал) минимален,
то состояние системы термодин. устойчиво.
При этом должно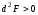
-Допустим
что система со всех сторон окружена
средой, температура и давление
которой
поддерживаются постоянными. Никакой
работы, помимо работы против внешнего
давления
система
совершать не может. И если
потенциал Гиббса (изобарно-изотерм.
потенциал) G=U-TS+pV
в некотором равновесном состоянии
достиг минимума, то равновесие будет
устойчивым. При этом должно быть
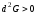
- Если объем и энтропия системы поддерживаются постоянными и система в некотором равновесном состоянии достигла минимума внутренней энергии, то равновесие термодинамически устойчиво.
- Если давление и энтропия системы поддерживаются постоянными и система в некотором равновесном состоянии достигла мини-мима энтальпии, то равновесие термодинам. устойчиво.
Замкнутая (адиабатически изолированная) система — максимум энтропии.
Система с фиксированными температурой и объёмом — минимум свободной энергии.
Система с фиксированными температурой и давлением — минимум потенциала Гиббса.
Система с фиксированными энтропией и объёмом — минимум внутренней энергии.
Система с фиксированными энтропией и давлением — минимум энтальпии. Принцип Ле-Шателье-Брауна: Если система находится о устойчивом рштовесии, то всякий процесс, вызванный а ней внешним воздействием или другим первичным процессом, всегда бывает направлен таким образом, что он стремится уничтожить изменения, произведенные внешним воздействием или первичным процессом.
