
- •1.Исторический обзор развития термодинамики и статистической физики.
- •2.Простые модельные системы. Конфигурации. Макросостояние и микросостояние системы. Однородное и неоднородное состояние системы
- •3.Распределение вероятностей для случайной физической величины. Теоремы сложения и умножения вероятностей.
- •4. Понятие вероятности. Статистическая независимость и квадратичная флуктуация
- •5.Равновесное и неравновесное состояния системы. Флуктуации. Необратимость. Энтропия.
- •6.Классическое описание движения механических систем. Канонические уравнения движения гамильтона
- •7.Фазовое пространство. Точка фазового пространства. Объем фазового пространства. Фазовая траектория. Статистический ансамбль.
- •8.Теорема лиувилля. Функция статистического распределения
- •11. Распределение Максвелла
- •12. Распределение Максвелла-Больцмана
- •13.Микроканонический ансамбль.
- •17. Уравнение состояния идеального газа
- •18. Одноатомный идеальный газ.
- •19. Двухатомный идеальный газ. Вращательная и колебательная степени свободы.
- •20.Классическая теория теплоемкости многоатомного идеального газа.
- •23.25. Квантово-механическое описание систем. У.Ш. Рассчет числа возможных состояний ид.Газа.
- •29.21 Теплоемкость твердых тел. Теория эйнштейна.
- •30. Теплоемкость твердых тел. Теория Дебая.
- •31. Теория флуктуаций
- •32.Термодинамическая система. Равновесные состояния и равновесные процессы. Температура. Нулевое начало.
- •33.Изопроцессы. Работа.
- •35. Теплоемкость газа.
- •36. Круговые процессы. Цикл Карно.
- •38. Процесс джоуля-томсона
- •40. Второе начало термодинамики.
- •41.Энтропия. З-н возраст.Э-пии
- •42. Неравенство клаузиуса. Общие условия термодин-го равновесия и устойчивости однородной системы.
- •43. Третье начало термод. И его следствия
- •44.Системы с переменным количеством вещества. Химический потенциал.
- •45.Равновесие фаз. Фазовые переходы первого рода
- •47. Броуновское движение. Уравнение фоккера-планка
- •48. Фазовые переходы второго рода. Теория ландау
- •51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
- •52. Каноническое распределение и термодин. Функции.
51.Явления переноса. Уравнение фурье. Нестационарное уравнение теплопроводности.
Явления переноса: диффузия, внутреннее трение (вязкость) и теплопроводность. Во всех трех явлениях происходит выравнивание свойств газа, если это свойство было первоначально неодинаковым в различных местах. Во всех трех случаях это осуществляется переносом некоторой величины из одной части газа в другую.
Если какую-то часть газа нагреть, то равновесие будет нарушено - возникнет поток тепла.
Опытным
путем установлен
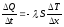 закон Фурье - тепло течет в направлении
убывания температуры. λ- коэффициент
теплопроводности. Общим для всех явлений
является то, что они протекают медленно,
хотя все они происходят благодаря
быстрым движениям молекул; явления в
широких пределах не зависят от давления.
Уравнение диффузии или уравнение
теплопроводности представляет собой
частный вид дифференциального уравнения
в частных производных. Бывает нестационарным
и стационарным. Математически уравнение
диффузии и уравнение теплопроводности
не различаются, и применение того или
иного названия ограничено только
конкретным приложением, причем второе
представляется более частным, так как
можно говорить, что в этом случае речь
идет о диффузии тепловой энергии. В
случае, когда ставится задача по
нахождению установившегося распределения
плотности или температуры (например, в
случае, когда распределение источников
не зависит от времени), из нестационарного
уравнения выбрасывают члены уравнения,
связанные с временем. Тогда получается
стационарное уравнение теплопроводности,
относящееся к классу эллиптических
уравнений.
закон Фурье - тепло течет в направлении
убывания температуры. λ- коэффициент
теплопроводности. Общим для всех явлений
является то, что они протекают медленно,
хотя все они происходят благодаря
быстрым движениям молекул; явления в
широких пределах не зависят от давления.
Уравнение диффузии или уравнение
теплопроводности представляет собой
частный вид дифференциального уравнения
в частных производных. Бывает нестационарным
и стационарным. Математически уравнение
диффузии и уравнение теплопроводности
не различаются, и применение того или
иного названия ограничено только
конкретным приложением, причем второе
представляется более частным, так как
можно говорить, что в этом случае речь
идет о диффузии тепловой энергии. В
случае, когда ставится задача по
нахождению установившегося распределения
плотности или температуры (например, в
случае, когда распределение источников
не зависит от времени), из нестационарного
уравнения выбрасывают члены уравнения,
связанные с временем. Тогда получается
стационарное уравнение теплопроводности,
относящееся к классу эллиптических
уравнений.
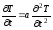 Нестационарное
уравнение диффузии классифицируется
как параболическое дифференциальное
уравнение. Оно описывает распространение
растворяемого вещества вследствие
диффузии или перераспределение
температуры тела в результате
теплопроводности.
Нестационарное
уравнение диффузии классифицируется
как параболическое дифференциальное
уравнение. Оно описывает распространение
растворяемого вещества вследствие
диффузии или перераспределение
температуры тела в результате
теплопроводности.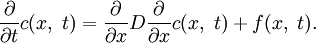
52. Каноническое распределение и термодин. Функции.
Наряду с энтропией можно пользоваться множеством других функций состояния. Если процесс квазистатический, то δQ = TdS. Для такого процесса уравнение первого начала δQ = dU + pdV; dU=TdS-pdV.Если ввести энтальпию I=U+pV то можно исключить U и получить dI=TdS+VdP. Так как TdS=δQ то при постоянном давлении dI=δQ. Отсюда видно, что энтальпия есть такая функция состояния, приращение которой в квазистатическом процессе при постоянном давлении дает количество тепла Q, полученное системой. По этой причине энтальпию называют тепловой функцией или теплосодержанием. Особенно важное значение имеют две функции состояния: свободная энергия F Гельмгольца, и термодинамический потенциал G, Гиббса. Эти функции состояния определяются выражениями F=U-TS, G=U-TS+pV. dF=-pdV-SdT, dG=Vdp-SdT. При изотермическом процесс dF=-δA, свободная энергия есть функция состояния системы, убыль которой в квазистатическом изотермическом процессе дает работу, произведенную системой. Полученные соотношения позволяют рассматривать данные функции, как функции аргументов S,V,T,p: U=U(T,S), I=I(S,P), F=F(V,T), G=G(p,T). Такого рода соотношения называются каноническими уравнениями состояния вещества. Если известна функция U(S, V), то дифференцированием ее но S и V можно найти температуру и давление системы, т. е. получить полные сведении о ее термических свойствах. Затем по формуле можно найти δQ и соответствующие теплоемкости, т. е. получить полные сведения также и о калорических свойствах системы. То же самое можно сделать с помощью любого из оставшихся трех канонических уравнений состояния.
