- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
Комплексные соединения - это соединения, характеризующиеся наличием ковалентных связей, образованных по донорно-акцепторному механизму. Это сложные вещества, в которых можно выделить:
1) внутреннюю сферу, в которую входят центральный атом (ион) – комплексообразователь и связанных, с ним донорно-акцепторными связями – лиганды;
2) внешнюю сферу, связанную с внутренней ионной связью.
Типичными комплексообразователями являются ионы d-металлов и некоторые ионы р-металлов, обладающие акцепторными свойствами благодаря наличию в их структуре свободных орбиталей.
Лиганды — частицы (молекулы или ионы), обладающие неподеленной парой электронов (доноры электронов): H2O, NH3, Cl-, Br-, J-, F-, CN-, OH-, CO и др.
Число лигандов во внутренней сфере называется координационным числом. Координационное число зависит от заряда центрального иона, и, как правило, в 2 раза больше него. Координационное число не является строго определенной величиной для данного иона. Для комплексообразующих ионов установлены следующие координационные числа:
|
заряд центрального иона: |
+1 |
+2 |
+3 |
+4 |
|
координационное число: |
2 |
4, 6 |
4, 6 |
8 |

Например: [Ag+(NH3)2]+Cl-
|
Ag+ |
|
|
|
|
|
|
|
|
|
|
4d |
|
|
|
|
5p |
|
|
|
|
|
|
|
|
5
** NH3 |
|
|
|
неподеленная
пара электронов **
NH3
Донорно-акцепторная связь в комплексах образуется за счет объединения валентной пары электронов атома лиганда (молекула аммиака) и вакантной орбитали комплексообразователя путем их взаимного перекрывания (s и р орбитали), в результате чего эта пара становиться общей для обоих атомов.
Форма комплексного иона определяется типом гибридизации атомных орбиталей центрального атома иона. У серебра задействованы две орбитали, значит это sp-гибридизация, комплекс имеет линейную форму.
Теория строения комплексных соединений предложена А. Вернером.
|
Заряд центрального атома |
Координационное число |
Форма комплексного иона |
Примеры |
|
+1 |
2 |
Линейная |
[Ag(NH3)2]Cl |
|
+2 |
4 редко 6 |
Тетраэдрическая Плоская квадратная |
[Cu(NH3)4]Cl2 K4[Fe(CN)6] |
|
+3 |
6 редко 4 |
Октаэдрическая Шестиугольная призматическая |
K3[Al(OH)6] K [Al(OH)4] |
Комплексные соединения бывают:
а) анионные (комплексный анион) – K4[Fe(CN)6];
б) катионные (комплексный катион) – [Cu(NH3)4]Cl2;
в) катионанионные (комплексный анион и катион) – [Cu(NH3)4][PtCl4];
г) нейтральные (комплексная группа нейтральная) – [Fe(CO)5]0
Номенклатура комплексных соединений
В названиях комплексных соединений сначала называют анион, потом катион. Используют греческие числительные: 2 – ди; 3 – три; 4 – тетра 5 – пента; 6 – гекса.
Названия лигандов: H2O – аква; NH3 – аммин; Cl- – хлоро; Br- – бромо; J- –йодо; F- – фторо, CN—циано; OH- – гидроксо, CO – карбонил; S2- –сульфо ; S2O32- – тиосульфо; NO2- –нитро; NO- –нитрозо ; SCN- – родано и др.
Если внутренняя сфера является анионом, используется латинское название центрального (комплексообразователя) с добавлением суффикса «ат» и указанием его степени окисления. Если центральный ион входит в состав комплексного катиона, то он называется по русски. Примеры:
K4[Fe(CN)6] – гексацианоферрат (II) калия;
[Cu(NH3)4]SO4 – сульфаттетрааммин меди (II);
[Fe(CO)5]0 – пента карбонил железо (0).
Комплексные соединения, как правило, сильные электролиты – хорошо диссоциируют на внутреннюю и внешнюю сферы, а диссоциация внутренней сферы протекает слабо (см. главу 7 таблица 9 «Диссоциация солей»). Прочность комплексного иона характеризуется константой нестойкости: чем меньше константа нестойкости, тем устойчивее комплексный ион (см. приложение 5 «Константы нестойкости комплексных соединений»).
Прочные и устойчивые к диссоциации донорно-акцепторные взаимодействия возникают между мягкими (легкополяризуемыми) комплексообразователями и мягкими лигандами.
К
Увеличение
мягкости

N
Увеличение
мягкости
Лиганды:

SO42-, NO3- , OH-, H2O ,Cl-, Br-, I- ,-S2O32 -, NO2-, NH3, SCN –, CN-
Химические свойства комплексных соединений
1. Реакции обмена по внешней сфере:
[Cu(NH3)4]SO4 + BaCl2 BaSO4 + [Cu(NH3)4]Cl2
2. Реакции разрушения комплексных ионов вследствие образования:
а) более устойчивого комплекса
[Cu(NH3)4]SO4 + 4HCl CuSO4 + 4NH4Cl (в кислых средах)
[Cd(NH4)4]SO4 + 4KCN K2[Cd(CN)4] +K2SO4
б) малорастворимого соединения
[Ag(NH3)2]Cl + KI AgI + KCl + 2NH3
в случае низкой прочность комплексного иона
в) малодиссоциирующего соединения (например, Н2О)
Na2[Zn(OH)4] +4HCl ZnCl2 +2NaCl +4H2O
3
-1e
2K4[Fe(CN)6] + Сl2 2K3[Fe(CN)6] + 2KCl
F +2e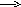
2Cl-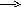
Рекомендуемая литература: [1], с. 354-378; [2], с. 71-81.