
- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Классификация и номенклатура солей
|
Средние соли кислородсодержащих кислот кислотный остаток отражает латинское название кислотообразующего элемента + окончание ат в случае максимальной степени окисления кислотообразующего элемента |
Na2S+6O4 Сульфат натрия |
|
При меньшей степени окисления используют окончание ит |
Na2S+4O3 Cульфит натрия |
|
Соли бескислородных кислот называют по международной номенклатуре, используя окончание ид |
Na2S Сульфид натрия |
|
Кислые соли - продукты неполного замещения водорода на металл (получают в избытке кислоты). Называют как и средние с добавлением приставки - гидро к названию кислотного остатка, если возможны две кислые соли, то впереди ставят греческое числительное |
Na2HPO4 Гидрофосфат Na NaH2PO4 Дигидрофосфат Na
|
|
Основные соли – продукты неполного замещения гидроксогрупп на кислотный остаток (получают в избытке основания). Называют, как и средние соли, добавляя к названию металла гидроксо, если возможны две основные соли, то впереди ставят греческое числительное |
MgOHCl Хлорид гидроксо Mg Al(OH)2Cl Хлорид дигидроксо Al |
Получение солей см. оксиды, основания, кислоты.
С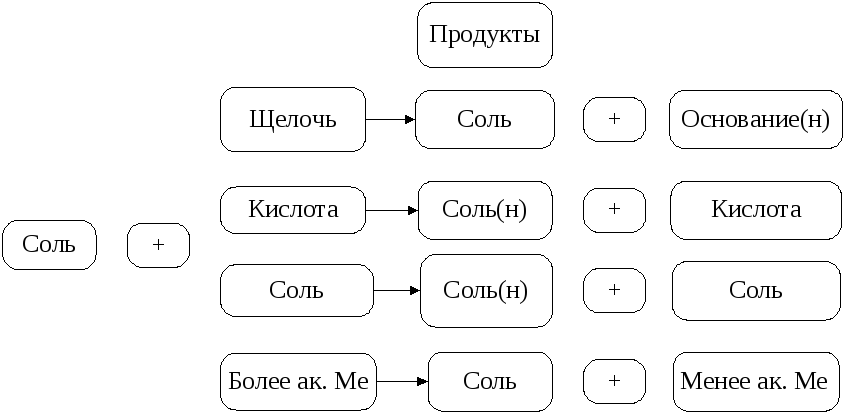 войства
солей определяются их строением, а
именно наличием ионов в узлах
кристаллической решетки. Следовательно,соли могут
вступать в реакции обмена с соединениями
состоящими из ионов, т.е. с кислотами
(р), щелочами, солями (р).
Для протекания реакции с солями необходимо
учитывать условия необратимости реакций,
а именно:
войства
солей определяются их строением, а
именно наличием ионов в узлах
кристаллической решетки. Следовательно,соли могут
вступать в реакции обмена с соединениями
состоящими из ионов, т.е. с кислотами
(р), щелочами, солями (р).
Для протекания реакции с солями необходимо
учитывать условия необратимости реакций,
а именно:
1) осадок ( ) 2) газ ( )3) слабый электролит, например Н2О (см. главу 7).
Рис. 9. Химические свойства солей
Примечание: см. приложение 1 – «Растворимость солей, кислот и оснований в воде»
Таблица 6
Номенклатура кислот и солей
|
Название кислоты |
Формула кислоты |
Название соли |
Примеры солей |
|
Соляная |
HCl |
Хлориды |
NaCl |
|
Хлорноватистая |
HСlO |
Гипохлориты |
NaClO |
|
Хлорноватая |
HClO2 |
Хлориты |
NaClO2 |
|
Хлористая |
HClO3 |
Хлораты |
NaClO3 |
|
Хлорная |
HClO4 |
Перхлораты |
NaClO4 |
|
Азотная |
HNO3 |
Нитраты |
KNO3 |
|
Серная |
H2SO4 |
Сульфаты |
K2SO4 |
|
Сернистая |
H2SO3 |
Сульфиты |
K2SO3 |
|
Сероводородная |
H2S |
Сульфиды |
K2S |
|
Фосфорная |
H3PO4 |
Фосфаты |
Ca3(PO4)2 |
|
Угольная |
H2CO3 |
Карбонаты |
CaCO3 |
|
Кремневая |
H2SiO3 |
Силикаты |
Na2SiO3 |
|
Циановодородная |
HCN |
Цианиды |
KCN |
|
Марганцовая |
HMnO4 |
Перманганаты |
KMnO4 |
|
Хромовая |
H2CrO4 |
Хроматы |
K2CrO4 |
|
Дихромовая |
H2Cr2O7 |
Дихроматы |
K2Cr2O7 |
Рекомендуемая литература: [1], с. 29-34.
Контрольные задания №1 Тема: «Классы неорганических соединений»
а) Возможны ли химические взаимодействия между предложенными веществами. Приведите уравнения реакций;
б) Состaвьте уравнения реакций, протекающих в цепи превращений. Назовите продукты реакций.
Примечание: для составления комплексных соединений см. главу 3 «Химическая связь. Комплексные соединения»
Варианты заданий
1. а) CO2: 1) HCl, 2) H2O, 3) KOH, 4) CaCO3, 5) MgO;
б) Сa CaO Ca(OH)2 CaCO3 CaCl2.
2. a) Fe(OH)2 : 1) CaO, 2) H2SO4, 3) KOH, 4) CuSO4, 5) SO3(t);
б) P P2O3 P2O5 H3PO4 K3PO4.
3. a) K2CO3 : 1) HClO4 , 2) H2O, 3) KOH, 4) HBr , 5) FeO;
б) Al Al2O3 AlCl3 Al(OH)3 KАlO2.
4. a) HCl : 1) Cu, 2) NH4OH, 3) CuSO4, 4) FeO, 5) CO2;
б) S SO2 SO3 H2SO4 K2SO4 BaSO4.
5. а) CaO : 1) HNO3, 2) H2O, 3) KOH, 4) SO2, 5) K2SO4;
б) Fe FeO FeCl2 Fe(OH)2 [FeOH]2SO4.
6. a) K2CO3 : 1) H2SO4, 2) Na2O, 3) Mg(OH)2, 4) ZnCl2, 5) H2O ;
б) СuO CuS Cu(NO3)2 Cu(OH)2 Cu(HSO4)2.
7. a) KOH: 1) HСlO, 2) Ca(OH)2, 3) CaCl2, 4) CO2, 5) Al(OH)2Cl;
б) C CO CO2 H2CO3 KHCO3 K2CO3.
8. a) HСlO4: 1)SO3, 2) FeO, 3) MnSO4, 4) HNO3, 5) NaOH;
б) Zn ZnO Zn (NO3)2 Zn (OH)2Na2ZnO2.
9. a) FeO: 1) H2SO4, 2) Al2O3, 3) K2SO3, 4) CO2, 5) KOH;
б) N2 NH3 N2O5 HNO3 Cu(NO3)2 Cu(OH)2.
10. a) AlCl3 : 1) HNO3, 2) H2O, 3) NaOH, 4) K2CO3, 5) CO2;
б) Al Al2O3 Al(NO3)3 Al(OH)3 NaAlO2.
11. a) H2O : 1) K2O, 2) CO2, 3) MnCl2, 4) Al2O3, 5) H2SO4;
б) Cl2 CaCl2 KCl HCl FeCl2 Fe(OH)2.
12. a) Na2SO3: 1) HCl, 2) BaCl2, 3) KOH, 4) CaSO4, 5) N2O5;
б) NH3 NH4Cl NH4OH Al(OH)3 NaAlO2.
13. a) H2CO3 :1) HCl, 2) CaCl2, 3) KOH, 4) SO2, 5) BaO;
б) SiO2 K2SiO3 H2SiO3 SiO2 CaSiО3.
14. a) Al2O3 : 1) H2SO4, 2) CaO, 3) KOH, 4) SO2, 5) K2SO4;
б) Na Na2O NaOH Cu(OH)2 CuSO4 H2SO4.
15. a) NaOH :1) ZnO, 2) SO2, 3) KHCO3, 4) Al(OH)3, 5) H2S;
б) S SO2 H2SO3 K2SO3 KOH KMnO4.
16. a) CuSO4 : 1) H2S, 2) BaCl2, 3) KOH, 4) HNO3, 5) CO2;
б) Ca Ca(OH)2 CaCO3 CaO Ca3(PO4)2.
17. a) Al(OH)3 : 1) HСlO4, 2) KCl, 3) KOH, 4) CaO+to, 5) CO2;
б) P P2O3 P2O5 H3PO4 NaH2PO4 Na3PO4.
18. a) ZnO : 1) H2SO4, 2) H2O, 3) NaOH, 4) CaO, 5) K3PO4;
б) Al2O3 Al Al(OH)3 K[Al(OH)4] AlCl3 Al(OH)3.
19. a) H2SO4 : 1) KCl, 2) K2O, 3) Zn(OH)2, 4) CO2, 5) Zn;
б) S SO2 SO3 H2SO4 KHSO4 K2SO4.
20. a) NaOH : 1) HCl, 2) Ba(OH)2, 3) Al(OH)2Cl, 4) FeCl2, 5) SO2;
б) Cr2O3 Cr CrCl3 Cr(OH)3 KСrO2.
21. a) CaO : 1) HCl, 2) CuSO4, 3) FeO, 4) CO2, 5) Al2O3;
б) Fe FeCl3 Fe(OH)3 Fe2O3 Fe FeCl3.
22. a) BeO: 1) HCl, 2) H2O, 3) NaOH, 4) K2O, 5) NaCl
б) Cu CuCl2 Cu(OH)2 CuO CuSO4 Cu(OH)2.
23. a) N2O5 : 1) NaCl, 2) H2O, 3) KOH, 4) CaO, 5) CO2;
б) Si SiO2 K2SiO3 H2SiO3 KHSiO3 K2SiO3.
24. a) HBr : 1) Zn, 2) KOH, 3) SO3, 4) FeO, 5) H2SO4;
б) S SO2 SO3 H2SO4 KHSO4 K2SO4.
25. a) KOH : 1) Al, 2) H2O, 3) H3PO4, 4) SO2, 5) FeCl2;
б) Al Al2O3 AlCl3 Al(OH)3 KАlO2.
