
- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Примеры кинетических расчетов
Задача 1. Как изменится скорость химической реакции А(газ) + 2В(газ) С(газ) при повышении концентрации вещества А в 2 раза, давления в 2 раза.
Согласно закону действующих масс, скорость реакции можно выразить по формуле V1 = k[A].[B]2
а) если повысить концентрацию А в 2 раза, то скорость будет равна V2 = k[2A].[B]2 = 2V1. Скорость увеличится в 2 раза;
б) если повысить давление, то для газообразных веществ это равносильно повышению концентрации каждого из реагирующих веществ в 2 раза: V3 = k[2A].[2B]2 = 8k[A].[B]2 = 8V1. Скорость увеличится в 8 раз.
Задача 2. Скорость некоторой реакции при 0 0С равна 1 моль/л. час. Температурный коэффициент реакции равен 3. Какой будет скорость данной реакции при 30 0С.
Решение:
По правилу Вант-Гоффа V2
= V1.
![]() =
1.33
= 27 моль/л
.час
=
1.33
= 27 моль/л
.час
Химическое равновесие
Химическое равновесие– это динамическое состояние системы, при котором скорости прямой и обратной реакции равны, то есть сколько молекул продукта реакции образуется в единицу времени, столько же и расходуется на обратную реакцию.
Для того чтобы показать, насколько полно протекает прямая реакция до момента установления химического равновесия, используют константу равновесия реакции – Кр, которая численно равна произведению равновесных концентраций продуктов реакций в степенях, равных стехиометрическим коэффициентам, поделенному на произведение равновесных концентраций исходных веществ в соответствующих степенях.
Если записать уравнение реакции в виде:
nA
+ mB
pC
+ gD
, то Kp
=
![]()
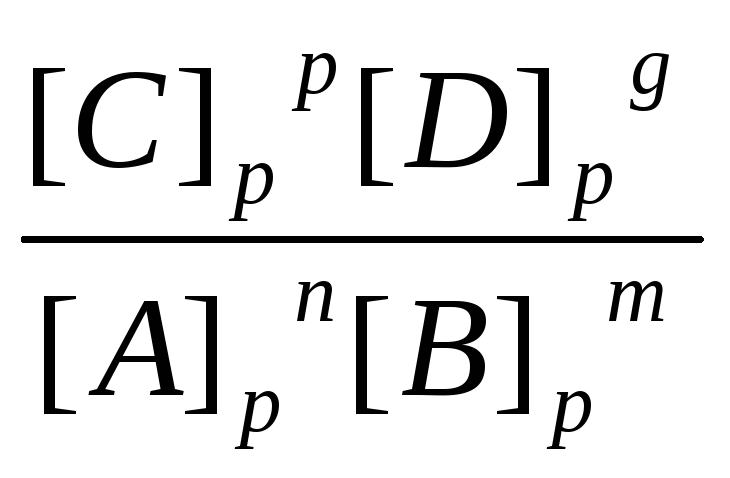 ,
где [C]р
, [D]р,
[A]р
, [B]р
–равновесные концентрации веществ.
Выражение выведено из закона действующих
масс при условии V
= V.
,
где [C]р
, [D]р,
[A]р
, [B]р
–равновесные концентрации веществ.
Выражение выведено из закона действующих
масс при условии V
= V.
В формуле учитываются только газообразные и растворенные вещества (если реакция идет в растворе).
Чем больше Кр, тем полнее идет прямая реакция. Если Кр 1, то на момент установления равновесия большая часть исходных веществ превратилась в продукты; если Кр 1, в продукты превратилась меньшая часть исходных веществ. Кр зависит от температуры и не зависит от концентрации исходных веществ.
Чтобы реакция на химических производствах проходила как можно полнее, необходимо сместить равновесие в сторону продукта.
Для того чтобы определить, как тот или иной фактор изменит равновесие в системе, используют принцип Ле-Шателье (1844г):
Если на систему, находящуюся в состоянии равновесия, оказывает влияние внешний фактор (температура, давление, концентрации исходных веществ и продуктов реакции), то равновесие смещается в сторону уменьшения этого воздействия.
Катализатор не влияет на смещение равновесия, так как одинаково ускоряет как прямую, так и обратную реакции, с помощью катализатора можно ускорить момент наступления равновесия.
Для того, чтобы определить как внешнее воздействие повлияет на равновесие, нужно знать, как сама реакция изменяет свои параметры.
Например О2 + 2SO2 2SO3 + Q
Прямая реакция:
а) повышает температуру (+Q)
б) понижает давление (до реакции 2+1 моль газов, после реакции - 2 моль газов);
в) концентрации исходных веществ снижает;
г) концентрацию продукта увеличивает
Значит, все противоположные воздействия: понижение температуры, повышение давления, повышение концентраций исходных веществ, выведение из системы продукта, будут способствовать смещению равновесия в сторону прямой реакции.
