
- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Пример расчета
При определенной температуре в системе N2 + 3H2 2NH3 установилось равновесие при следующих концентрациях: N2 - 0,1моль/л, H2 - 0,15 моль/л, NH3 - 0,02 моль/л. Найдите константу равновесия этой реакции и начальные концентрации исходных веществ. Найдите концентрацию азота в другой равновесной смеси при той же температуре, если концентрация в ней Н2 - 0,2 моль/л, а NH3 - 0,03 моль/л.
Решение:
Запишем уравнение реакции и выразим
Кр в общем виде: N2
+ 3H2
2NH3,
Кр =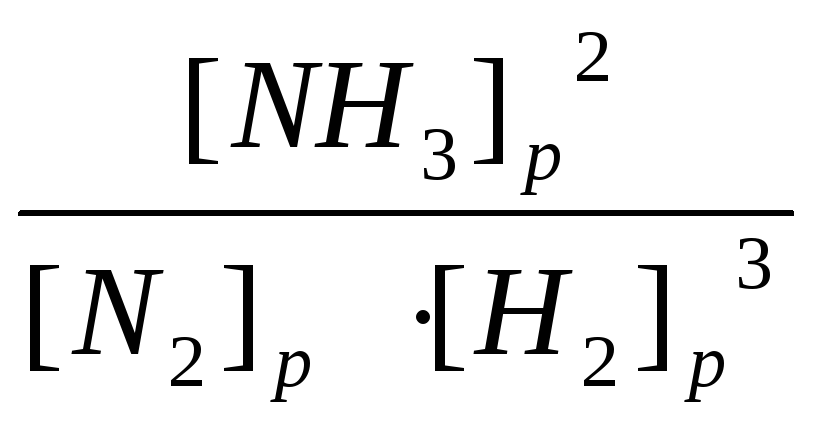 .
.![]()
Найдем константу равновесия для первой смеси
Кр
=
![]() 1,185.
1,185.
Зная
константу равновесия можно определить
концентрацию азота во второй смеси
[N2]![]() =
=![]()
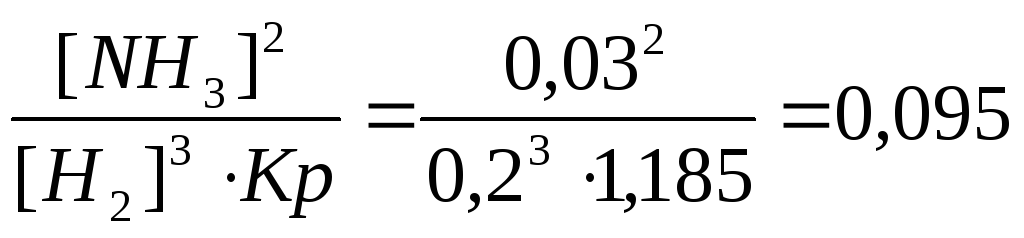 моль/л
моль/л
По уравнению реакции можно определить начальные концентрации исходных веществ: х моль y моль 0,02 моль
N2 + 3H2 2NH3
По уравнению реакции 2 моль NH3образуется из 1моль N2 и 3 моль H2
Составим пропорцию по уравнению и найдем количества молей N2 и H2 пошедших на образование 0,02 моля NH3
х
=
![]() мольN2
(расход),
y
=
мольN2
(расход),
y
=![]() моль/лH2
(расход)
моль/лH2
(расход)
Начальные концентрации были:
С0(N2) = Ср(N2) + Срасход(N2) = 0,1+ 0,01 = 0,11 моль/л
С0(Н2) = Ср(Н2) + Срасход(Н2) = 0,15+ 0,03 = 0,18 моль/л
Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
Варианты заданий
Реакция протекает по уравнению А(газ) + 2В(газ) = 2С(газ) в начале реакции концентрации реагирующих веществ одинаковы и равны 1 моль/л, через 1мин концентрация вещества В стала 0,6 моль/л. Какой стала концентрация А и С? Какова скорость этой реакции по веществу В?
Реакция идет по уравнению 2А(газ) + 2В(газ) = 2С(газ). Во сколько раз и как изменится скорость реакции в следующих случаях:
а) при увеличении концентрации вещества А в 3 раза,
б) при увеличении концентрации вещества В в 3 раза,
в) при увеличении давления в 3 раза,
г) при увеличении давления в 2 раза и уменьшении концентрации вещества В в 2 раза.
При 500 0С реакция протекает за 50 минут, температурный коэффициент равен 2. За сколько минут она пройдет при 520 0С?. Если считать, что эта реакция 2Н2 +О2 = 2Н2О, то сколько граммов воды образуется при 520 0С за 5 мин из 22, 4 л О2.
В системе N2 + 3H2 2NH3 установилось равновесие при концентрации N2 – 5 моль/л, H2 – 2 моль/л, NH3 – 2 моль/л. Найдите концентрации исходных веществ до начала реакции.
При 425 0 0С в одном из опытов равновесные молярные концентрации водорода и йода были по 1,14 .10-3 моль/л, йодоводорода – 8,41.10-3 моль/л. Найдите концентрацию водорода в другой равновесной смеси, если в ней концентрация йодоводорода – 15,6.10-3 моль/л и йода – 1,25.10-3 моль/л.
Равновесие в системе H2 + I2 2HI установилось при следующих концентрациях: H2 – 0,25 моль/л, I2 – 0,05 моль/л, HI – 0,9 моль/л. Определите исходные концентрации йода и водорода (если считать, что все вещества находятся в газовой фазе), найдите константу равновесия данной реакции.
Какие внешние факторы смещают равновесие в сторону прямой реакции:
а) СО2(газ) + С(тв) 2СО(газ) –Q
б) N2(газ) + O2(газ) 2NO(газ) –Q
в) CaO + CO2(газ) CaCO3 + Q
Какие внешние факторы смещают равновесие в сторону обратной реакции:
а) СО2(газ) + С(тв) 2СО(газ) – Q
б) N2(газ) + O2(газ) 2NO(газ) – Q
в) CaO + CO2(газ) CaCO3 + Q
Выведите константу равновесия для обратимой реакции:
СО2(газ) + С(тв) 2СО(газ) . В каком направлении будет смещаться равновесие с повышением давления.
При 508 0С константа скорости реакции: H2 + I2(тв) 2HI , равна 0, 16 моль/л мин. Исходные концентрации H2 – 0,04 моль/л, а I2 – 0,05 моль/л. Вычислите начальную скорость и скорость в тот момент, когда концентрация водорода станет равной 0,03 моль/л.
В каком направлении будет смещаться равновесие с повышением температуры и давления для реакции: 2О2 2О3 H= 184,6 кДж. Выведите константу равновесия системы.
В системе : CO(газ) + Cl2(газ) COCll2(газ), начальные концентрации CO и Cl2 – были равны 0,28 моль/л и 0,09 моль/л; равновесная концентрация СО равна 0,02 моль/л. Найдите константу равновесия.
Выведите константу равновесия для обратимой реакции:
SO3 (газ) + C(тв) SO2(газ) + CO(газ). В каком направлении будет смещаться равновесие с повышением давления?
Начальные концентрации веществ, участвующих в реакции:
4HCl + O2 2Cl2+ 2H2O, составляют: HCl – 4,8 моль/л, O2 – 1,8 моль/л, Cl2 – 0,01моль/л. Определите концентрации всех реагирующих веществ после того, как концентрация О2 уменьшилась до 1,0 моль/л.
В каком направлении будет смещаться равновесие с повышением температуры и давления для реакции: N2(газ) + O2 (газ) 2NO(газ) H= 180,7 кДж.
Выведите константу равновесия для обратимой реакции:
SO2 (газ) + О2 SO3(газ) . Вычислите равновесные концентрации SO2 и О2, если исходные концентрации соответственно равны 6 и 4 моль/л, а концентрация SO3 – 2 моль/л.
В каком направлении будет смещаться равновесие с повышением температуры и давления для реакции: СО(газ) + Cl2(газ) COCl2(газ), H= 112,57 кДж. Вычислите константу равновесия и начальную концентрацию хлора и СО, если равновесные концентрации веществ: СО – 0,2 моль/л, Cl2 – 0,3 моль/л, COCl2 – 1,2 моль/л.
Выведите константу равновесия для обратимой реакции:
Н2S (газ) + 3О2 2SO2(газ) +2Н2О(газ). В каком направлении будет смещаться равновесие с повышением давления?
При синтезе аммиака к данному моменту времени прореагировало 0,9 моль/л водорода, его начальная концентрация была равна 1,4 моль/л. Определите концентрацию оставшегося водорода и прореагировавшего азота. Выведите константу равновесия системы.
Выведите константу равновесия для обратимой реакции:
CaO(тв) +3C(тв) CaC2 (тв) + CO(газ).
Для реакции : FeO(тв) + 3CO(тв) Fe(тв) +CO2(газ) константа равновесия при 1000 0С равна 0,5. Начальные концентрации CO и CO2 были соответственно равны 0,05 моль/л и 0,01 моль/л. Найдите их равновесные концентрации.
В каком направлении будет смещаться равновесие с повышением температуры и понижением давления для реакции: N2(газ) + 3Н2(газ) 2NН3(газ) H=-92,4 кДж? Каковы исходные концентрации водорода и азота, если: равновесные концентрации Н2 – 9 моль/л, N2 – 3 моль/л, NН3 – 4 моль/л.
Концентрации NO и O2 , образующих NO2, были соответственно равны 0,03 моль/л и 0,05 моль/л. Как изменится скорость реакции, если концентрацию О2 повысить до 0,1 моль/л, а NO до 0,06 моль/л?
Выведите константу равновесия для обратимой реакции:
4P(тв) + 5О2 2P2O5(тв).
В процессе реакции, протекающей по уравнению : А + 3В С за определенный промежуток времени концентрация вещества А уменьшилась на 0,03 моль/л. Как изменилась при этом концентрация вещества В и скорость реакции?
