
- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Пример составления овр
Н
ок-ль вос-ль
среда
Определим степень окисления элементов в соединениях. Степень окисления у марганца +7 (наивысшая, соответствующая номеру группы в ПСЭ), следовательно, Мn+7может проявлять только окислительные свойства. Наиболее устойчивой в кислой среде для марганца является степень окисления +2. Сера в сероводороде имеет степень окисления -2, т.е. низшую. Следовательно, S-2 может проявлять только восстановительные свойства, и переходит в следующую степень окисления, равную нулю.
О кислительMn+7
+ 5e
Mn+2
2 процесс
восстановления
кислительMn+7
+ 5e
Mn+2
2 процесс
восстановления
Восстановитель S-2 -2е –2e S0 5 процесс окисления
Коэффициент 2 - для окислителя, 5 - для восстановителя, так как количество электронов отданных восстановителем (-2е ·5 =-10е), должно равняться количеству электронов, принятых окислителем(+5е ·2 =+10е).
По правой части электронного баланса пишем предполагаемые продукты реакции:
![]()
Mn+2 MnO Mn(OH)2 MnSO4.
Свободная сера выпадает в осадок, калий при обмене со средой образует K2SO4, а водород и кислород не участвующие в передаче электронов, образуют воду. Расставляем коэффициенты согласно балансу:
2KMnO4 + 5H2S + 3H2SO4 2MnSO4 + 5S + K2SO4 + 8H2O
Особенности взаимодействия металлов с кислотами и щелочами
Характерное химическое свойство всех металлов – их восстановительная активность, т.е. способность атомов отдавать электроны, превращаться в положительные ионы. Активность металлов согласуется с их положением в электрохимическом ряду напряжений, т.е. в ряду стандартных электродных потенциалов (см. Приложение 9 – «Электрохимический ряд напряжений металлов»).
1.В разбавленных растворах кислот окислителем является Н+ (кроме растворов азотной кислоты)
2. При взаимодействии металлов с кислотами - окислителями нужно учитывать активность металла и влияние температуры – чем активнее металл и выше температура процесса, тем глубже идет восстановление окислителя.
![]()
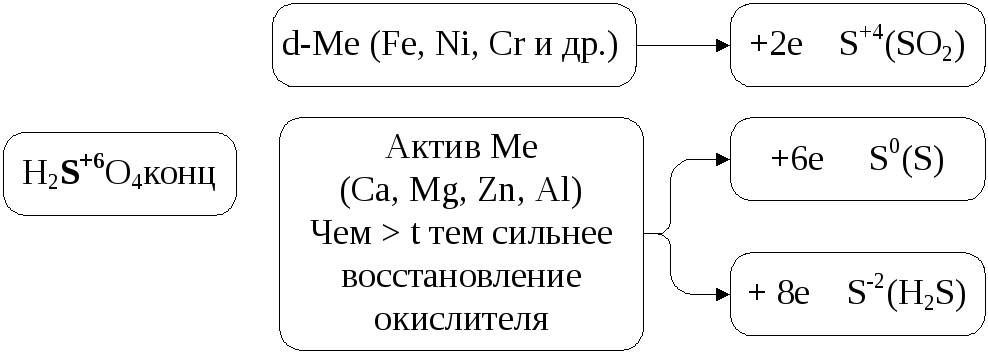
Рис. 12. Окислительная активность концентрированного раствора H2SO4
2 Fe
+ 6H2SO4
t
Fe2(SO4)3
+ 3SO2
+ 6H2O
Fe
+ 6H2SO4
t
Fe2(SO4)3
+ 3SO2
+ 6H2O
восстановитель Fe0 – 3e Fe+3 2 процесс окисления
окислитель S+6 +2e S+4 3 процесс восстановления
3. Некоторые металлы (Fe, Co, Ni, Mn, Cr, Al) на холоду пассивируются концентрированными кислотами - азотной, серной:
F
4. Особенности взимодействия азотной кислоты:
В концентрированных и разбавленных растворах окислителем является азот (N+5)
При взаимодействии концентрированной азотной кислоты с металлами, как правило, образуется диоксид азота (N+4O2)
Ч
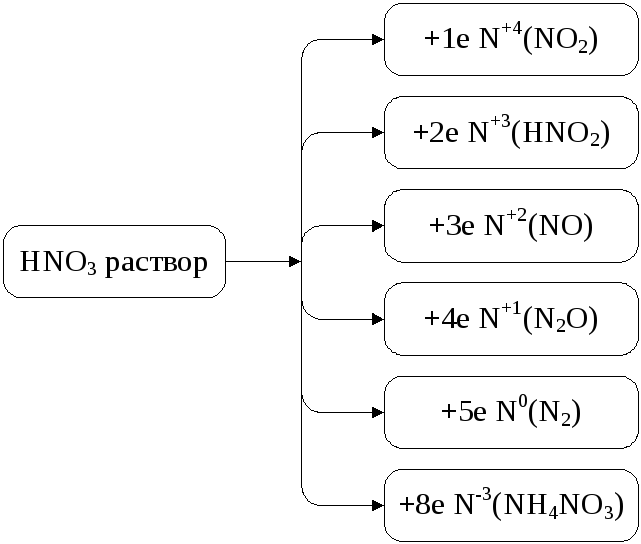 ем
разбавленнее кислота и чем активнее
металл, тем глубже идет восстановлениеN+5
(рис. 13).
Варьируя концентрацию азотной кислоты
и активность металла, можно получить
соответствующие оксиды, свободный
азот или соль аммония:
ем
разбавленнее кислота и чем активнее
металл, тем глубже идет восстановлениеN+5
(рис. 13).
Варьируя концентрацию азотной кислоты
и активность металла, можно получить
соответствующие оксиды, свободный
азот или соль аммония:
Рис.13. Окислительная активность раствора HNO3
5Zn + 12HNO3(очень разб) 5Zn(NO3)2 + N2 + 6H2O
Zn - 2e Zn+2 10 5
2N+5 + 10e N2 2 1
5. В щелочах растворяются только амфотерные металлы, вытесняя водород и образуя анионы соответствующих кислот (цинкаты, алюминаты, плюмбиты и т. п.):
Zn0 + 2NaOH+1 Na2Zn+2O2 +H20 или Zn0+ 2NaOH+1 Na2[Zn+2(OH)4] +Н20
в расплаве в растворе
Z n
–2e
Zn+2
2 1
n
–2e
Zn+2
2 1
2H+ +2e H2 2 1
Z n+2ZnOZn(OH)2
n+2ZnOZn(OH)2
 амфотерный
H2ZnO2
NaOH
Na2ZnO2
амфотерный
H2ZnO2
NaOH
Na2ZnO2
