
- •Н.М. Тетерина Учебное пособие по неорганической химии
- •Введение
- •Глава 1. Классы неорганических соединений
- •Основания
- •Двойственность амфотерных гидроксидов
- •Номенклатура кислот
- •Взаимодействие кислот с металлами
- •Классификация и номенклатура солей
- •Номенклатура кислот и солей
- •Контрольные задания №1 Тема: «Классы неорганических соединений»
- •Глава 2. Строение атома. Периодическая система элементов д.И. Менделеева
- •Размещение электронов по энергетическим уровням
- •Электронная формула
- •Общая характеристика элементов по семействам
- •Характеристика элементов по классам, исходя из электронной конфигурации атома
- •Контрольное задание №2 Тема: «Строение атома. Периодическая система элементов д.И. Менделеева »
- •Глава 3. Химическая связь. Комплексные соединения.
- •Пример образования химической связи в соединении
- •Рекомендуемая литература: [1], с. 97-167; [2], с. 35-64.
- •Контрольное задание №3 Тема: «Химическая связь»
- •Тема: «Комплексные соединения»
- •Глава 4. Кинетика химических реакций. Химическое равновесие
- •Примеры кинетических расчетов
- •Химическое равновесие
- •Пример расчета
- •Рекомендуемая литература: [1], с.186-210; [2], с. 149-203. Контрольные задания № 4 Тема: «Кинетика химических реакций. Химическое равновесие»
- •Глава 5. Термодинамика химических процессов
- •Пример термодинамических расчетов
- •Рекомендуемая литература: [1], с.168-185; [2], с.116-148. Контрольные задания № 4 Тема :«Термодинамика химических процессов»
- •Глава 6. Способы выражения концентраций растворов
- •Рекомендуемая литература: [1], с.216-221 контрольные задания №6 Тема: «Способы выражения концентрации растворов»
- •Глава 7. Теория электролитической диссоциации. Ионные реакции
- •Характеристика электролитов
- •Диссоциация солей
- •Рекомендуемая литература: [1], с.231-246; [2], с.218-224. Контрольные задания №7 Тема «Теория электролитической диссоциации. Ионные реакции»
- •Глава 8. Водородный показатель. Гидролиз солей
- •Цвет универсального индикатора в зависимости от рН
- •Примеры расчетов рН и концентрации растворов веществ
- •Гидролиз солей
- •Рекомендуемая литература: [1], с.249-258;[2], с.224-242. Контрольное задание № 8 Тема : «Водородный показатель. Гидролиз солей»
- •Глава 9. Коллигативные свойства растворов
- •Рекомендуемая литература: [1], с.225-230; [2], с.205-208. Контрольное задание №9 Тема: «Коллигативные свойства растворов»
- •Глава 10. Окислительно-востановительные реакции
- •Окислительно-восстановительные свойства веществ
- •Составление уравнений окислительно-восстановительных реакций методом электронного баланса
- •Пример составления овр
- •Особенности взаимодействия металлов с кислотами и щелочами
- •Рекомендуемая литература: [1], с.259-267;[2], с.251-278. Контрольное задание № 10 Тема : «Окислительно-востановительные реакции»
- •Глава 11. Электрохимия. Гальванические элементы
- •Пример расчета эдс медно-цинкового гальванического элемента
- •Рекомендуемая литература: [1], с.273-280, с. 681-685;[2], с. 300-310. Контрольное задание №11 Тема: «Электрохимия. Гальванические элементы»
- •Глава 12. Электролиз
- •Приближенные значения перенапряжения водорода и кислорода на различных материалах.
- •Примеры электролиза водных растворов электролитов
- •Пример расчета количества выделившихся веществ при электролизе
- •Рекомендуемая литература:[1], с.281-288, с. 677-681; [2],с.279-299. Контрольное задание №12 Тема: «Электролиз»
- •Глава 13. Коррозия металлов
- •Механизм электрохимической коррозии
- •Пример расчета коррозии Ме в результате образования гальванического элемента.
- •Рекомендуемая литература: [1], с.685-693; [2], с.311-340. Контрольное задание №13 Тема: «Коррозия металлов»
- •Глава 14. Свойства металлов
- •Контрольное задание №14 Тема: «Свойства металлов»
- •Глава 15. Синтетические высокомолекулярные соединения
- •III. По химическому составу:
- •IV. По структуре макромолекулы:
- •V. По пространственному строению:
- •VI. По физическим свойствам:
- •Рекомендуемая литература: [1], с.603-616; л.2, с.450-474 контрольное задание №15 Тема: «Синтетические высокомолекулярные соединения»
- •Словарь терминов и персоналий
- •Рекомендуемая литература
- •Приложения
- •Растворимость солей, кислот и оснований в воде*
- •Термодинамические константы некоторых веществ*
- •Плотность растворов кислот, щелочей, аммиака различных концентраций при 150с
- •Константы диссоциации кислот
- •Константы нестойкости комплексных ионов
- •Степени диссоциации кислот, оснований и солей в 0,1 н водных растворах (при 180с)*
- •Криоскопические константы некоторых растворителей
- •Эбуллиоскопические константы некоторых растворителей
- •Электрохимический ряд напряжений металлов
- •Стандартные окислительно-востановительные потенциалы в водных растворах по отношению к нормальному водородному электроду
- •Содержание
Глава 5. Термодинамика химических процессов
После изучения этой темы вы должны:
усвоить понятия: система, процесс, внутренняя энергия, работа, энтальпия, энтропия, энергия Гиббса, эндотермический, экзотермический процесс;
знать первый закон термодинамики, закон Гесса, расчет изменения энтальпии реакции;
второй закон термодинамики, уметь на его основе прогнозировать направления самопроизвольного протекания процессов.
Первый закон термодинамики. Теплота, подведенная к системе (тело или группа взаимодействующих тел) идет на совершение системой работы (А) и на изменение внутренней энергии системы (U): Q = U + А
А – энергетическая мера направленных форм движущихся частиц. Химическая, электрическая, механическая энергии входят в работу.
U – прирост внутренней энергии. Внутренняя энергия (U) слагается из вращательного, колебательного движения атомов, молекул, а также энергии движения электронов.
Большинство реакций протекает при Р = const, для этих условий Qр = U + РV, где РV = А.
Qр принято обозначать - Н, т.е. Q р = - Н
Н - называют изменением энтальпииилитепловым эффектом реакции.
Для расчета теплового эффекта используют стандартные теплоты образования (Н0) и сгорания (Н0сгор) веществ.
Тепловой эффект реакцииравен сумметеплот образования (Н0) конечных продуктов реакции за вычетом суммы теплот образования начальных веществ (следствие из закона Гесса):
Н = Н0 (продуктов) - Н0 (исходных веществ)
Если даны стандартные теплоты сгорания, то тепловой эффект можно вычислить по формуле:
Н = Н0сгор.(исходных веществ) - Н0сгор. (продуктов)
Н0,Н0сгор – важнейшие термодинамические характеристики веществ, определенные при стандартных условиях (Т = 298К, р = 1 атм). Теплота образования для простых веществ, устойчивых в стандартных условиях, условно принимаемая равной 0. Н0, зависит от агрегатного состояния.
Тепловой эффект реакции может иметь положительное и отрицательное значения: Н 0, энергия в ходе реакции поглощается (эндотермический процесс); если Н 0, энергия в ходе реакции выделяется – экзотермический процесс. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические (см. главу 5). Высокая энергия активации является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя принципиально возможны. Так, в обычных условиях самопроизвольно не загораются: дерево, бумага, керосин и др. вещества (рис.11).
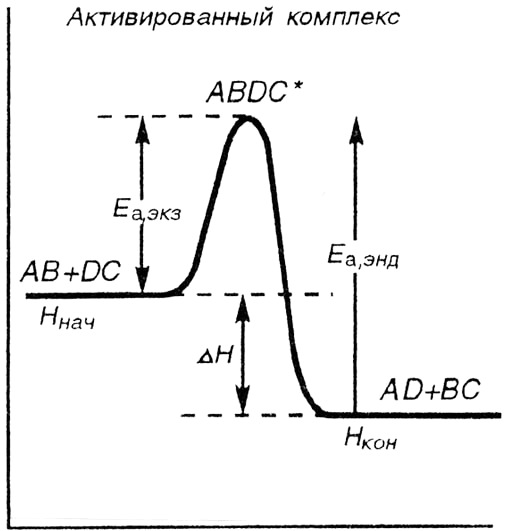
Рис. 11. Энергетическая диаграмма хода реакции с образованием активированного комплекса
Ннач.- Нкон.= Н – теплота реакции (тепловой эффект реакции) которая выделяется в системе при р, Т = const.
Чем определяется способность химической реакции к самопроизвольному протеканию?
Второй закон термодинамики. С точки зрения молекулярно-кинетических представлений второе начало термодинамики можно сформулировать следующим образом:все процессы стремятся перейти самопроизвольно от менее вероятного состояния (например, упорядоченное движение частиц вещества)к состоянию более вероятному – беспорядочное хаотичное движение.Мерой хаотичности выступает термодинамическая функция –энтропия (S).S = /T [Дж/K].
Различают энтропию вещества (S0обр) и энтропию процесса ( S). При изменении агрегатных состояний веществ: твердое жидкое газообразное увеличивается беспорядок, т.е. увеличивается энтропия.
Энтропия реакции равна сумме энтропии (S0обр) конечных продуктов реакции минус сумма энтропий начальных веществ (следствие из закона Гесса):
S = S0(продуктов) - S0(исходных веществ)
Наиболее вероятные процессы протекают с ростом энтропии, т.е. S 0
Исходя из первого начала термодинамики: S = Q/T = (U+A)/T A = TS - U, где TS- часть энергии, которая не может быть превращена в работу, а может только рассеиваться в виде тепла.
Для р, Т = const A = -G (изобарно-изотермический потенциал) или энергия Гиббса
G = Н - TS, Н – количество теплоты выделяемое или поглощаемое в ходе реакции (или изменение теплосодержания) при р, Т= const, G- часть энергии системы, за счет которой, может быть, совершена работа:
G 0 – реакция не возможна;
G = 0 – система находится в динамическом равновесии;
G 0 – реакция протекает самопроизвольно.
Таким образом, химический процесс зависит от энтальпийного (Н) и энтропийного (S) термодинамических факторов системы: чем меньше Н и больше TS, тем более вероятность протекания реакции.
G химических реакций, протекающих при стандартных условиях, можно рассчитать по формуле: G = G0(продуктов) - G0(исходных веществ).
