
Поверхностные явления и дисперсные системы
.pdf
71
Зависимость интегральной теплоты адсорбции от числа адсорбированных молекул представлена на рис. 3.11.
qÆ |
Теор. |
|
|
Практ. |
|
|
|
|
|
|
|
Na
Рис. 3.11. Изменение интегральной теплоты адсорбции при увеличении числа адсорбированных молекул.
Дифференциальная теплота адсорбции qd – это количество тепла, выделившегося в отдельных стадиях адсорбции.
Производная от интегральной теплоты адсорбции по количеству адсорбированного вещества при T = const называется дифференциальной теплотой адсорбции, Дж/моль.
|
dqu |
|
|
qd |
|
||
|
dNa T
|
|
d E´ Ea |
|
|
|
|
. |
(3.77) |
|
E´ Ea Na |
|
|||
|
|
|
|
|
|
dNa |
|
||
E´ = f(T) при Т = const dE´ = 0. Для идеального газа E´ явля-
ется только функцией температуры, поэтому |
|
|
||
dEa |
|
|
||
qd E´ Ea Na |
|
. |
(3.78) |
|
|
||||
|
|
|
||
dNa |
|
|||
|
|
T |
|
|
По мере насыщения активных центров адсорбция идет на менее активных центрах, что приводит к уменьшению дифференциальной теплоты адсорбции.
3.5.9. Кинетика мономолекулярной адсорбции
Процесс адсорбции может протекать с различной скоростью . Под кинетикой адсорбции понимают изменение величины адсорбции с течением времени t
72 |
|
|
|
|
A f ( t ); |
|
|
(3.79) |
|
f |
|
dA |
. |
(3.80) |
|
||||
(t) |
|
|||
dt
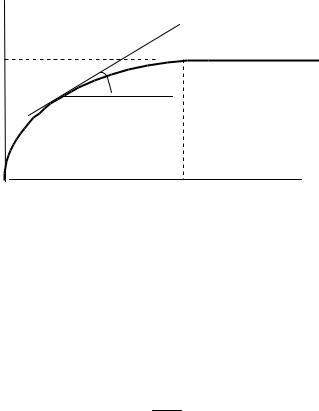
Производная от величины адсорбции по времени характеризует скорость адсорбции. Уравнения (3.79) и (3.80) называют уравнениями кинетической кривой в интегральной и дифференциальной форме. Интегральная зависимость A f ( t ) изображена на рис. 3.12, где Ap величина адсорбции при равновесии.
В начальный момент при t = 0 A = 0. Затем с увеличением времени растет величина адсорбции А. Скорость адсорбции в каждый данный момент времени графически определяется как тангенс угла наклона касательной к оси абсцисс.
Отсюда видно, что вначале процесса адсорбции скорость адсорбции наибольшая. По мере протекания адсорбции ее величина приближается к значению Ap , адсорбция достигает предельного
значения, устанавливается адсорбционное равновесие, а скорость адсорбции становится равной нулю.
Скорость адсорбции на однородной поверхности с образованием мономолекулярного слоя складывается из скоростей двух
A
Ap
tg
t
Рис. 3.12. Кинетическая кривая адсорбции
противоположных процессов. Скорость прямого процесса определяется скоростью закрепления молекул адсорбата на поверхности адсорбента 1, обратного – скоростью удаления молекул с поверхности 2 . Скорость адсорбции равна разницы скоростей прямого и обратного процесса 1 2 . Степень заполнения поверхности
определяется выражением A , доля свободной поверхности
A
73
равна 1 . Скорость прямого процесса пропорциональна числу столкновений молекул адсорбата с единицей поверхности адсорбента, доле свободной поверхности 1 и доле молекул , способных к закреплению на поверхности: 1 1 . Скорость обратного процесса пропорциональна доле уходящих молекул с единицы площади насыщенной поверхности и степени заполнения
поверхности: 2 . Скорость |
адсорбции |
d |
выразится |
||||
dt |
|||||||
суммарным уравнением |
|
|
|
|
|||
|
|
|
|
|
|||
|
d |
|
2 |
1 . |
(3.81) |
||
|
|
||||||
|
dt |
1 |
|
|
|
||
|
|
|
|
|
|
||
После преобразования и интегрирования получим |
|
||||||
|
|
p 1 e kct . |
(3.82) |
||||
или |
A Ap 1 e kct . |
|
|||||
|
|
(3.83) |
|||||
где p – степень заполнения поверхности при достижении равновесия; Ap – величина адсорбции при достижении равновесия; kc –
константа скорости адсорбции; t – время.
Полученное уравнение отражает зависимость, показанную на рис. 3.12. Если после установления адсорбционного равновесия давление в системе уменьшить до нуля, то начнется процесс десорбции. При условиях пренебрежения адсорбцией, получим
ŸÇ¯ |
d |
. |
(3.84) |
|
|||
|
dt |
|
|
Интегрируя, получаем |
|
||
pe t . |
(3.85) |
||
Уравнение (3.85) характеризует кинетику десорбции.

74
3.5.10. Адсорбция газов и паров на пористых телах. Потенциальная теория Поляни
Пористые тела – это твердые тела, внутри которых имеются поры, которые определяют наличие внутренней межфазной поверхности. Поры могут быть заполнены газом или жидкостью. Пористые тела относятся к дисперсным системам с твердой дисперсионной средой и газообразной или жидкой фазой.
Потенциальная теория Поляни была предложена для термодинамического описания полимолекулярной адсорбции. В основе этой теории лежали следующие положения:
1)Адсорбция обусловлена чисто физическими силами.
2)На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи поверхности адсорбента, образуя непрерывное силовое поле (рис.3.13).
1 2 |
|
2 |
W 0 |
1 |
|
Рис. 3.13. Схематический разрез адсорбционной фазы |
|
по Поляни |
|
3)Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном слое других молекул, вследствие чего возможна полимолекулярная адсорбция.
4)Адсорбционные силы не зависят от температуры и, следова-
тельно, с изменением температуры адсорбционный объем не изменяется.
Адсорбционный объем может быть представлен посредством ряда эквипотенциальных поверхностей, изображенных (в разрезе) на рис.
75
3.13. Каждая поверхность соответствует определенному значению адсорбционного потенциала i . Адсорбционным потенциалом называется работа обратимого изотермического процесса по переносу одного моля адсорбата из данной точки адсорбционного объема в газовую фазу, 1 2 . Максимальный адсорбционный потенциал наблюдается в точках вблизи поверхности адсорбента. Таким образом, состояние газа в адсорбционном слое рассматривается так же, как и состояние газа в объеме в области больших давлений и низких температур.
3.6. Адсорбция на границе твердое тело – раствор
Адсорбция растворимых веществ из раствора твердыми адсорбентами является более сложным случаем, чем адсорбция газов. Так как из жидкой фазы могут адсорбироваться, по меньшей мере, два компонента: растворитель и растворенное вещество (одно или несколько), поэтому молекулы растворителя могут конкурировать с молекулами адсорбата за места на поверхности адсорбента.
При рассмотрении адсорбции из раствора на твердом теле различают молекулярную адсорбцию (адсорбцию из растворов неэлектролитов), ионную адсорбцию (адсорбцию из растворов сильных электролитов) и ионообменную адсорбцию (ионный обмен).
3.6.1. Молекулярная адсорбция
Неэлектролиты и слабые электролиты адсорбируются на поверхности адсорбента в виде молекул, такой процесс называют молекулярной адсорбцией.
При адсорбции из жидких растворов поверхность адсорбента всегда полностью занята молекулами растворителя и растворенного вещества. Растворенное вещество может адсорбироваться, только вытесняя из поверхностного слоя молекулы растворителя, т. е. происходит обменная молекулярная адсорбция.
Для бинарного раствора фундаментальное уравнение Гиббсаd ´i d i имеет вид
i |
|
d ´1d 1 ´2d 2 , |
(3.88) |
76
где ´1, ´2 – величина гиббсовской адсорбции компонентов 1 (растворитель) и 2 (растворенное вещество) соответственно.
Чтобы связать величины гиббсовской адсорбции с концентрациями компонентов в растворе, используем уравнение ГиббсаДюгема
x1d 1 x2d 2 0 , |
(3.89) |
где x1, x2 – молярные доли 1 и 2 компонентов в растворе соответственно. Отсюда
d |
|
x2 |
d |
2 |
. |
(3.90) |
|
||||||
1 |
|
x1 |
|
|
|
|
|
|
|
|
|
|
Подставляем уравнение (3.90) в (3.88),получаем
d ´ |
|
x2 |
d |
2 |
´ |
2 |
d |
2 |
, |
(3.91) |
||||||
|
|
|||||||||||||||
|
|
|
1 x |
|
|
|
|
|
||||||||
преобразуем |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
|
|
|
|
||
d |
´ |
|
´ |
x2 |
|
|
|
. |
|
|
(3.92) |
|||||
|
2 |
|
|
2 |
|
|
||||||||||
|
|
|
1 x |
|
|
|
|
|
|
|
||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||
Для получения зависимости ´2 f x2 |
при постоянной тем- |
|||||||||||||||
пературе допустим, что общее количество молей компонентов 1 и 2 в поверхностном слое до и после адсорбции остается одним и тем же. Тогда при адсорбции добавление одного компонента в поверхностном слое будет равно убыли другого компонента, следовательно Г2 Г1. Подставляя это соотношение в уравнение (3.92), полу-
чаем |
|
|
|
x2 |
|
d ´2 1 |
|
d 2 . |
x |
||
|
1 |
|
Так как x1 x2 1, то |
|
|
|
x2 |
|
d ´2 1 |
|
d 2 . |
1 x |
||
|
2 |
|
(3.93)
(3.94)
Приводим в скобке к общему знаменателю и сокращаем, получаем
77
1 |
|
|
|
d ´2 |
|
d 2 . |
(3.95) |
1 x |
|||
2 |
|
|
|
Отсюда адсорбция растворенного вещества равна
´ |
|
1 x |
|
d |
. |
(3.96) |
|
|
|||||
|
2 |
2 |
|
d 2 |
|
|
Уравнение химического потенциала второго компонента реального раствора
|
|
|
2 |
|
0 |
RT ln a , |
|
|
|
|
|
||
дифференцируем |
|
|
|
2 |
|
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
da2 |
|
|
||
d |
2 |
RTd ln a |
иначе d |
2 |
RT |
. |
(3.97) |
||||||
|
|||||||||||||
|
|
|
|
|
2 |
|
|
a2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||
Подставляем уравнение (3.97) в (3.96), получаем
´ |
2 |
1 x |
|
a2 |
|
d |
. |
(3.98) |
|
|
|||||||
|
2 |
|
RT da |
|
||||
|
|
|
|
2 |
|
|
||
Уравнение (3.98) представляет уравнение изотермы адсорбции Гиббса, где Г2 – величина гиббсовской адсорбции растворенного вещества (для растворителя принимается индекс 1); x2 – молярная доля растворенного вещества; a2 – активность растворенного вещества, которая связана с концентрацией c через коэффициент активности 2 следующим уравнением 2 2 c ; – поверхностное натяжение на границе двух фаз твердое тело – жидкость.
Это уравнение справедливо для всей области концентраций. Для разбавленных растворов, когда x2 0, уравнение Гиббса имеет вид
´2 |
|
a2 |
|
d |
, |
(3.99) |
|
|
|||||
|
|
RT da2 |
|
|||
С ростом концентрации раствора адсорбция на границе твердое тело – раствор возрастает до предельного значения Г (рис.

78 |
|
|
|
|
3.15). В разбавленном растворе 2 = 1 и a2 c , |
поэтому |
для |
рас- |
|
творенного вещества уравнение (3.99) переходит в широко исполь- |
||||
зуемое адсорбционное уравнение Гиббса |
Г c |
d . |
|
|
Г2 |
RT dc |
|
|
|
|
|
|
|
|
´ |
|
|
|
|
|
c |
|
|
|
Рис. 3.15. Изотерма адсорбции на границе |
|
|
||
твердое тело – раствор |
|
|
|
|
Для восходящей ветви хорошее совпадение с экспериментальными результатами дает уравнение Фрейндлиха и уравнение Ленгмюра.
Величину гиббсовской адсорбции можно определить экспериментально:
´ |
(c0 c )V |
, |
(3.100) |
|
|||
|
s |
|
|
где c0 – исходная концентрация растворенного вещества в объеме (до адсорбции); c – равновесная концентрация растворенного вещества в объеме (после адсорбции); V – объем жидкой фазы, из которого происходит адсорбция; s – поверхность раздела фаз.
Процесс адсорбции состоит из двух стадий:
1.Подвод вещества к поверхности осуществляется за счет диффузии, протекает медленно.
2.Собственно адсорбция, протекает быстро.
Скорость первой медленной стадии можно увеличить, введя перемешивание раствора, при этом увеличивается скорость конвективной диффузии. Процесс адсорбции является обратимым процессом. Обратный процесс – десорбция. Адсорбционное равновесие устанавливается долго (до суток).

79
Факторы, влияющие на величину молекулярной адсорбции.
1. Концентрация раствора. С ростом концентрации раствора адсорбция на границе раздела фаз твердое тело – раствор возрастает до предельного значения (рис. 3.15). Анализ экспериментальных изотерм показывает, что молекулярная адсорбция из растворов может быть описана, кроме уравнения Гиббса, также уравнением Лен-
гмюра A A Kc или Фрейндлиха A Kc1/ n . 1 Kc
2. Свойства адсорбата и адсорбента, влияние природы растворителя. Величина адсорбции зависит от свойств адсорбата и адсорбента. К свойствам адсорбата относятся пористость и полярность. Чем больше поры адсорбента и меньше молекулы адсорбата, тем больше адсорбция.
Влияние полярности адсорбата и адсорбента. При адсорбции соблюдается принцип подобия: неполярный адсорбат лучше адсорбируется на неполярном адсорбенте, а полярный адсорбат – на полярном адсорбенте. Адсорбируемость веществ на границе раздела конденсированных фаз A / C определяется правилом уравнивания полярностей Ребиндера: вещество B может адсорбироваться на границе раздела фаз A / C , если оно будет уравнивать полярности этих фаз. Вещество B должно обладать средней полярностью. Чем больше разница между полярностью растворенного вещества и растворителя, тем меньше его растворимость, тем лучше адсорбция. Полярность можно характеризовать диэлектрической постоянной. При соблюдении условия A B C или A B C на межфазной границе A / C идет адсорбция вещества B .
Рассмотрим адсорбцию ПАВ. При адсорбции ПАВ на границе раздела фаз твердое тело – раствор и раствор – газ имеет место пространственная ориентация молекул адсорбата. Полярная часть молекулы ориентирована к полярной фазе, а неполярная часть к неполярной фазе и происходит выравнивание полярностей на границе конденсированных фаз (рис. 3.16).
Например, при адсорбции ПАВ из водных растворов на угле (неполярный адсорбент) неполярная часть молекулы (углеводородный радикал) обращена к поверхности адсорбента, а полярная часть погружена в воду (неполярный растворитель).
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращенное правило Дюкло – Траубе:
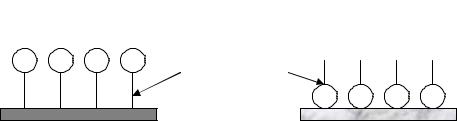
80
с ростом длины радикала адсорбция уменьшается. Так как с ростом длины углеводородной цепи растворимость ПАВ в неполярных растворителях увеличивается.
Н2О (полярный |
С6Н6 |
(неполярный |
|
растворитель) - |
|||
растворитель) |
|||
|
|||
|
Молекула |
|
|
|
ПАВ |
|
|
Уголь |
|
Силикагель |
|
(неполярный |
|
(полярный |
|
адсорбент) |
|
адсорбент) |
|
Рис. 3.16. Адсорбция ПАВ из водного раствора и бензола
Влияние природы растворителя определяется правилом Шилова: чем лучше растворяется адсорбат (адсорбтив) в растворителе, тем хуже он адсорбируется поверхностью твердого адсорбента; чем хуже растворяется – тем лучше адсорбируется.
3. Влияние температуры. Так как тепловой эффект процесса адсорбции имеет отрицательное значение, то с повышение температуры адсорбция уменьшается. Но, если растворимость адсорбата в данном растворителе падает с ростом температуры, то адсорбция может увеличиваться с ростом температуры.
3.6.2. Адсорбция сильных электролитов
Адсорбция электролитов не укладывается в рамки учения о молекулярной адсорбции, так как адсорбент может по-разному адсорбировать ионы, на которые распадается молекула электролита в растворе. Адсорбция сильных электролитов из водных растворов получила название ионной адсорбции. Наибольшее практическое значение имеют водные растворы электролитов, которые и будут далее рассматриваться. Природа адсорбентов имеет существенное значение, так как ионы адсорбируются только на поверхностях, состоящих из ионов или полярных молекул. Микроучастки поверхности, несущие определенный заряд, адсорбируют противоположно заряженные ионы. При этом ионы электролита, несущие одинаковый знак с поверхностью, непосредственно не адсорбируются, но под действием сил электрического притяжения уже адсорбирован-
