
Поверхностные явления и дисперсные системы
.pdf21
образования единицы площади поверхности раздела. Природа соприкасающихся фаз в значительной степени зависит от дипольного момента, диэлектрической проницаемости, поляризуемости. Ребиндер показал, что чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела. Поверхностное натяжение на границе двух жидкостей зависит от поверхностных натяжений жидкостей 1 и 2 на границе с газом. Межфазное натяжение на границе этих жидкостей является результатом силовых полей обеих жидких фаз и подчиняется закону аддитивности. Выражением этой закономерности является эмпирическое правило Антонова Г.Н.: если жидкости растворимы друг в друге ограниченно, то поверхностное натяжение на границе двух жидкостей равно разности между поверхностными натяжениями жидкостей на границе их с воздухом или их собственным паром
12 1 2 . |
(2.13) |
2.4. Термодинамика поверхности раздела фаз в однокомпонентной системе
Главная особенность поверхности раздела фаз определяется тем, что на очень малых расстояниях вглубь от межфазной поверхности (в пределах нескольких молекулярных размеров) физические и химические свойства вещества существенно отличаются от аналогичных свойств макроскопической (объемной фазы) того же вещества. Такой подход называется šметодом слоя конечной толщины®.
Поверхность раздела фаз не является плоскостью šнулевойŸ толщины, а реально представляет тонкий поверхностный слой малой, но конечной толщины >0. Поверхностный слой неоднороден, так как состоит из двух разных областей, примыкающих к двум разным фазам. Термодинамические параметры поверхностного слоя включают как поверхностную энергию s , так и энергию объема слоя
G¯°V , имеющего те же свойства, что и объемные фазы
G¯° s G¯°V . |
(2.14) |
Энергия Гиббса системы в этом методе определяется уравнением
22
|
|
V |
(2.15) |
G G1 |
G2 |
G¯° s , |
где G1, G2 – энергия Гиббса соответственно фазы 1 и фазы 2 до границы поверхностного слоя (поверхности разрыва).
Другим методом, описывающим термодинамические параметры поверхностного слоя, является метод избыточных величин Гиббса: все изменения термодинамических параметров в поверхностном слое на границе раздела фаз по сравнению с параметрами объемной фазы следует относить к разделяющей поверхности, не имеющей ни объема, ни толщины. При таком рассмотрении поверхность характеризуется избыточными термодинамическими параметрами, непосредственно отражающими проявление поверхностной энергии. Объемные фазы считаются однородными вплоть до разделяющей поверхности. В соответствии с этим методом энергия Гиббса системы (G ) равна сумме энергий Гиббса объемных фаз 1 и 2 (G1 , G2 ) и поверхностной энергии Гиббса ( s ), которая является избыточной
G G1 G2 s . |
(2.16) |
Далее используется в основном более простой и распространенный метод избыточных величин Гиббса.
2.5. Внутренняя (полная) удельная поверхностная энергия. Зависимость энергетических параметров поверхности от температуры
Известно выражение G H TS , отсюда энтальпия поверхности (ее избыток) выражается уравнением
H G TS . |
(2.17) |
Для единицы поверхности уравнение имеет вид: Hs Gs TSs . Для поверхностного слоя из уравнения H U PV , с учетом использо-
23
вания метода избыточных величин, т. е. с учетом того, что поверхностный слой не имеет объема V 0 , получаем для единицы раздела поверхности Hs Us . Поэтому избыток внутренней энергии единицы поверхности (для конденсированных систем) равен:
Us Gs TSs . |
(2.18) |
Индекс s означает отнесение потенциалов к единице поверхности. В соответствии со вторым законом термодинамики избыточная
энтропия равна
Ss |
qs |
, |
(2.19) |
|
|||
|
T |
|
|
где qs – теплота образования единицы поверхности (в обратимом процессе). Иногда эту величину называют скрытой теплотой образования поверхности. Она равна количеству теплоты, которое необходимо сообщить телу, чтобы при постоянной температуре увеличить его поверхность на единицу площади. Подставляем уравнение (2.10) и (2.19) в уравнение (2.18). Получаем, что внутренняя энергия единицы поверхности (ее избыток) определяется уравнением
Us qs . |
(2.20) |
Внутренняя энергия единичной поверхности индивидуальных веществ U s складывается из поверхностного натяжения (энергии Гиббса) и теплоты образования единицы поверхности. Для индивидуальных веществ теплота qs 0, так как при образовании поверхности теплота поглощается. В результате внутренняя удельная поверхностная энергия больше поверхностной энергии Гиббса на теплоту образования единицы поверхности. Поэтому ее обычно называют полной поверхностной энергией.
Из уравнения (1.7) при постоянстве всех параметров, кроме температуры, имеем для единицы поверхности

24
dGs Ss dT .
Отсюда |
G |
|
|
|
|
|
|
|
|
||
|
s |
|
Ss |
||
T |
|||||
|
p |
|
|
||
или |
|
|
G |
|
|
|
|
||||
|
Ss |
s |
. |
||
|
T |
||||
|
|
|
p |
||
Согласно уравнению (2.19)
qs SsT ,
с учетом (2.22) получаем
|
G |
|
|
|
|
qs SsT T |
s |
|
T |
|
. |
T |
|
||||
|
p |
|
T p |
||
Подставляем (2.24) в (2.20), получаем
|
|
|
Us T |
|
. |
|
||
|
T p |
|
(2.21)
(2.22)
(2.22)
(2.23)
(2.24)
(2.25)
Это уравнение называется уравнением Гиббса-Гельмгольца. Оно связывает полную поверхностную энергию (удельную) с поверхностным натяжением (энергией Гиббса).
Для определения полной поверхностной энергии нужно знать зависимость поверхностного натяжения от температуры. Для конкретных веществ эту зависимость получают экспериментально, но некоторые выводы можно сделать из уравнения (2.24). Для индивидуальных веществ теплота qs всегда положительна, а это значит, что температурный коэффициент поверхностного натяжения отрицателен
T p
|
G |
|
|
|
|
|
s |
|
0 . |
(2.26) |
|
T |
|||||
|
p |
|
|

|
25 |
Для |
многих однокомпонентных жидкостей зависимость |
f T |
близка к линейной зависимости. При линейном характере |
зависимости производная |
d |
, |
для данного вещества име- |
|
|||
|
dT |
|
|
ет постоянное значение и равна температурному коэффициенту поверхностного натяжения жидкости с обратным знаком.
Таким образом, поверхностное натяжение снижается с повышением температуры. С физической точки зрения это объясняется тем, что с ростом температуры расстояние между молекулами в жидких телах увеличивается, и, соответственно, равнодействующая межмолекулярных сил уменьшается. Для большинства неполярных жидкостей эта зависимость линейная. Для этих жидкостей полная поверхностная энергия почти не зависит от температуры. Продифференцируем по температуре уравнение Гиббса-Гельмгольца (2.25)
|
Us |
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||
|
|
|
|
T |
|
, |
(2.27) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|||||||||
|
T |
|
|
|
|
|
|
|
|
|
T |
|
|
||||||
|
p |
|
|
T p |
|
|
T p |
|
|
p |
|
||||||||
получаем |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
Us |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
T |
|
. |
|
|
|
(2.28) |
||||||||
|
|
|
|
|
|
2 |
|
|
|
||||||||||
|
|
|
|
T |
|
|
|
|
T |
|
|
|
|
|
|||||
|
|
|
|
p |
|
|
|
|
p |
|
|
|
|
||||||
Так как для неполярных жидкостей поверхностное натяжение линейно снижается с повышением температуры, то
T p
Т.е.
|
|
|
|
|
2 |
|
|
|
const , а |
|
|
0 . |
|||||
T |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
p |
|
|
|
U |
s |
|
0, |
|
|
||
|
|
|
|
|
||||
s |
|
|
||||||
|
p |
|
|
|
|
|||
(2.29)
(2.30)
Отсюда следует, что полная поверхностная энергия не зависит от температуры.

|
26 |
|
Us |
U s |
|
qs |
||
qs |
||
|
|
Tкр T
Рис. 2.3. Зависимость удельных избытков термодинамических параметров от температуры в поверхностном слое
Так как поверхностное натяжение снижается с температурой, а полная энергия от нее не зависит, то в соответствии с уравнением Us qs , теплота образования единицы поверхности увеличивается с ростом температур. Температурные зависимости показаны на рис. 2.3. При критической температуре исчезает межфазная поверхность, и соответственно снижаются до нуля все ее энергетические характеристики.
2.6. Влияние природы и концентрации растворенного вещества на поверхностное натяжение жидкостей.
Поверхностное натяжение растворов отличается от поверхностного натяжения чистого растворителя 0 . Зависимость поверхностного натяжения раствора от его концентрации при постоянной температуре называется изотермой поверхностного натяжения.
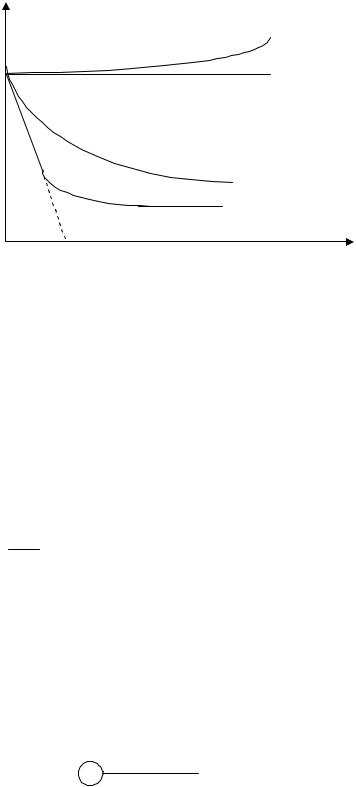
Для водных растворов различают три основных типа изотерм (рис.2.4). Первый тип изотерм (кривые 1а и 1б) образуют поверхно- стно-инактивные вещества (ПИВ). Это вещества, растворение которых не изменяет или слегка повышает величину поверхностного натяжения. Для этих веществ производная от поверхностного натяжения по концентрации равна нулю или больше нуля
d 0 (кривая 1а); d 0 (кривая 1б).
dc |
dc |
27
Поверхностно-инактивные вещества имеют большую полярность, чем чистый растворитель. К этому классу относятся почти все водные растворы электролитов – кислот, щелочей, солей.
1б
0
1а
2
3
4 (ККМ) |
c |
Рис. 2.4 Зависимость поверхностного натяжения от концентрации раствора
Второй тип изотерм (кривая 2) образуют поверхностноактивные вещества (ПАВ). Это вещества, снижающие при растворении поверхностное натяжение жидкости. Поверхностно-активные вещества менее полярны, чем чистый растворитель. К этому классу (в случае водных растворов) относится большинство органических соединений: кислоты и их соли, спирты, эфиры, амины и др. С ростом концентрации ПАВ поверхностное натяжение уменьшается,
следовательно, d 0 . dc
Молекулы ПАВ – дифильны, т. е. имеют гидрофильную и гидрофобную группировки. Гидрофильная группировка (функциональная группа) – это полярная группа, которая имеет сродство к полярной фазе: COOH , OH , SH , NH2 , NO2 , CHO , SO2OH
и др. Гидрофобная группировка (углеводородная цепь или радикал)
– неполярная часть молекулы. Изображение молекулы ПАВ:
полярная углеводородный группа радикал
28
На кривой 2 падение поверхностного натяжения в области малых концентраций имеет линейных характер, а затем с ростом концентраций изменяется по логарифмическому закону. Зависимость по логарифмическому закону хорошо описывается уравнением Б.А. Шишковского для низших гомологов С7 – С8:
0 B ln( 1 Ac ) , |
(2.31) |
где c – концентрация раствора; A, B – эмпирические константы. Третий тип изотермы (кривая 3) образуют мицеллообразующие
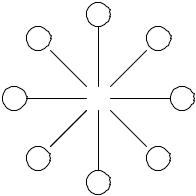
ПАВ (мыла). Их молекулы содержат гидрофобный радикал и сильно гидратирующуюся полярную группу. В растворах таких соединений при некоторой небольшой концентрации (точка 4), называемой
критической концентрацией мицеллообразования (ККМ), самопроизвольно образуются агрегаты из ориентированных молекул – мицеллы (рис. 2.5).
Мицеллы почти не снижают поверхностное натяжение раствора. Поверхностное натяжение мицеллярных растворов определяется, главным образом, индивидуальными молекулами ПАВ. Этим объясняются резкое снижение поверхностного натяжения в области концентраций до ККМ и почти постоянная величина в поле ККМ при мицеллообразовании.
Рис. 2.5. Мицелла ПАВ в воде
Благодаря дифильному строению ПАВ их молекулы образуют ориентированный монослой на поверхности раздела фаз. Полярные группы располагаются в водной (полярной) фазе, а гидрофобные радикалы – в газовой (неполярной) фазе.
29
2.7.Самопроизвольное уменьшение поверхностной энергии
иформирование поверхностного слоя
Так как увеличение поверхности сопровождается затратой работы на разрыв межмолекулярных связей (энергия системы увеличивается), то обратный процесс (уменьшение поверхности) должен происходить самопроизвольно, потому что сопровождается уменьшением энергии Гиббса поверхностного слоя.
Поверхностная энергия определяется уравнением G s s ,
поэтому G s уменьшается как за счет сокращения поверхности s , так и за счет снижения поверхностного натяжения . Поверхность может самопроизвольно уменьшаться при изменении формы тела, что характерно для жидкостей. Мелко раздробленные твердые и жидкие тела, обладающие большим избытком поверхностной энергии, стремясь уменьшить ее, самопроизвольно агрегируют (твердые тела) или коалесцируют (сливаются), что характерно для жидких тел. Стремление поверхности уменьшить свою энергию обуславливает стремление к снижению поверхностного натяжения. У твердых тел, как правило, поверхностное натяжение снижается вследствие адсорбции других веществ. Адсорбционной способностью обладают и жидкости, на поверхности которых происходит еще и определенная ориентация молекул.
Таким образом, структура поверхностного слоя формируется в результате самопроизвольного уменьшения поверхностной энергии. Процессы, самопроизвольно протекающие на границе раздела фаз и приводящие к уменьшению свободной энергии, называются поверхностными явлениями. Рассмотрим эти явления.
2.8. Межмолекулярные и межфазные взаимодействия. Когезия. Адгезия. Смачивание и растекание жидкостей
2.8.1. Когезия
В гетерогенных системах различают межмолекулярные взаимодействия внутри фаз (когезия) и между фазами (адгезия).
Взаимодействие (сцепление) молекул, атомов, ионов внутри одной фазы (гомогенной части системы) называют когезией. Когезия определяет существование веществ в конденсированном со-
30
стоянии. Она может быть обусловлена межмолекулярными и межатомными взаимодействиями различной природы. Когезионные силы иногда называют силами аттракции (притяжения).
Количественно когезионное взаимодействие определяется работой когезии. Если столб жидкости сечением 1 м2 разорвать по плоскости, перпендикулярной поверхности цилиндра (столба), совершив работу против сил сцепления молекул, то в результате разрыва столба жидкости образуются две новых поверхности жидкость
– воздух площадью 1 м2, т.е. в этом процессе совершается работа когезии.
Работа когезии Wк определяется затратой энергии на обратимый изотермический разрыв тела по сечению, равному единице площади.
Так как работа образования единицы поверхности равна поверхностному натяжению, а при разрыве образуется поверхность в две единицы площади, то работа когезии равна удвоенному значению поверхностного натяжения жидкости на границе с газом
Wк 2 . |
(2.32) |
Применительно к твердому телу величину Wк часто называют
прочностью на разрыв или когезионной прочностью.
2.8.2. Адгезия
Адгезия (прилипание, склеивание) – это взаимодействие между приведенными в контакт поверхностями конденсированных тел разной природы.
Адгезия обеспечивает между двумя телами соединение определенной прочности благодаря физическим или химическим межмолекулярным силам. Различают адгезию между двумя жидкостями, между жидкостью и твердым телом и между двумя твердыми телами. Количественно адгезия характеризуется работой адгезии.
Работа адгезии Wa определяется работой обратимого разрыва адгезионной связи, отнесенной к единице площади.
Представим себе систему, состоящую из твердой и жидкой соприкасающихся фаз, с поверхностью раздела 1 м2. Разорвем систему по сечению, где соприкасаются фазы, т. е. осуществим работу против сил сцепления между разнородными молекулами (рис. 2.6).
