
Поверхностные явления и дисперсные системы
.pdf11
1.3 Классификация дисперсных систем
Существует несколько классификаций дисперсных систем. 1. Классификация основана на различии в агрегатных состояниях дисперсной фазы и дисперсионной среды. Три агрегатных состояния (твердое, жидкое и газообразное) позволяют выделить девять типов дисперсных систем (табл. 1). Для краткости их обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель – дисперсионной среды. Обозначение Т/Ж показывает, что система состоит из твердой дисперсионной фазы и жидкой дисперсионной среды (твердое тело раздроблено в жидкости). Одно из девяти сочетаний Г/Г не может соответствовать коллоидной системе, так как газы дают истинные растворы. Однако газовые смеси могут проявлять отдельные свойства гетерогеннодисперсных систем благодаря непрерывным флуктуациям плотности и концентрации, вызывающим неоднородности в системе.
Таблица 1 Классификация дисперсных систем по агрегатному состоянию
Дисперсионная |
Дисперсная |
Условное |
Название системы и примеры |
||||
среда |
фаза |
обозначение |
|||||
|
|
|
|
||||
|
твердая |
Т/Т |
твердые гетерогенные системы: |
||||
|
минералы, сплавы, бетон |
|
|||||
|
|
|
|
||||
|
|
|
капиллярные |
системы: |
жид- |
||
Твердая |
жидкая |
Ж/Т |
кость в пористых телах, адсор- |
||||
бенты в |
растворах, |
почвы, |
|||||
|
|
||||||
|
|
|
грунты |
|
|
|
|
|
|
|
пористые тела: адсорбенты и |
||||
|
газообразная |
Г/Ж |
катализаторы |
в газах, твердая |
|||
|
|
|
пена, пемза, пенобетон |
|
|||
|
|
|
суспензии и золи: пульпы, взве- |
||||
|
твердая |
Т/Ж |
си, пасты, илы, промышленные |
||||
|
|
|
суспензии |
|
|
|
|
Жидкая |
жидкая |
Ж/Ж |
эмульсии: |
природная |
нефть, |
||
кремы, молоко, смазки |
|
||||||
|
|
|
|
||||
|
|
|
газовые эмульсии и пены: фло- |
||||
|
газообразная |
Г/Ж |
тационные, |
противопожарные, |
|||
|
|
|
мыльные пены |
|
|
||
12
|
|
|
аэрозоли (пыли, дымы): порош- |
|
|
твердая |
Т/Г |
ки, табачный дым, угольная |
|
|
|
|
пыль, дым |
|
Газообразная |
|
|
аэрозоли (туманы): туман, об- |
|
жидкая |
Ж/Г |
лака, тучи, промышленные ту- |
||
|
||||
|
|
|
маны |
|
|
газообразная |
Г/Г |
системы с флуктуациями плот- |
|
|
ности: атмосфера Земли |
|||
|
|
|
2. Классификация по концентрации частиц дисперсной фазы (по кинетическим свойствам, по структуре). Все дисперсные системы можно разделить на два класса: свободнодисперсные системы и связнодисперсные системы. В свободнодисперсных системах при малых концентрациях дисперсных частиц частицы находятся на больших расстояниях, поэтому дисперсные частицы не взаимодействуют друг с другом и представляют собой самостоятельные кинетические единицы. В таких системах дисперсная фаза подвижна (суспензии, эмульсии, золи). Частицы с размерами меньше 10 9 м не относят к коллоидным и образуют молекулярные или ионные растворы (истинные растворы). В связнодисперсных системах при больших концентрациях дисперсных частиц частицы контактируют друг с другом. Такие системы образуют различные типы коллоидных структур, в них одна из фаз не перемещается свободно, поскольку структурно закреплена (капиллярно-пористые тела, гели, студни, пены, твердые растворы).
Свободнодисперсные и связнодисперсные системы по-разному классифицируются по степени дисперсности (табл. 2,3).
Таблица 2 Классификация свободнодисперсных систем по дисперсности
Тип |
Размер |
Название, |
|
системы |
частиц, м |
примеры |
|
Ультрамикро- |
10 9 |
– 10 7 |
золи, коллоидные системы: твердые зо- |
ли (Т/Т), аэрозоли (Т/Г), лиозоли (Т/Ж, |
|||
гетерогенные |
|
|
Ж/Ж, Г/Ж) |
|
|
|
|
Микрогетерогенные |
10 7 |
– 10 5 |
суспензии: (Т/Ж), эмульсии (Ж/Ж), пе- |
|
|
|
ны (Г/Ж), порошки (Т/Г) |
Грубодисперсные |
> 10 5 |
системы (Т/Г): песок, щебень и др. |
|
13
Таблица 3 Классификация связнодисперсных систем (пористых тел)
по Дубинину
Типы систем |
Размер пор, м |
Микропористые |
до 2½10 9 |
Переходнопористые |
2½10 9 – 2½10 7 |
Макропористые |
> 2½10 7 |
3.Классификация дисперсных систем по межфазному взаимодействию (по характеру взаимодействия дисперсной фазы и дисперсионной среды). Взаимодействие между веществами дисперсной фазы и дисперсионной среды за счет межмолекулярных сил на границе раздела фаз протекает всегда, но степень его проявления может быть различной. В зависимости от этого дисперсные системы могут быть лиофильными и лиофобными (лат. lios – жидкость, filio – любить, fobio – ненавидеть).
Для лиофильных систем характерно сильное молекулярное взаимодействие вещества дисперсной фазы с дисперсионной средой, для лиофобных – слабое. Это взаимодействие приводит к образованию сольватных оболочек (гидратных оболочек в случае воды) из молекул дисперсионной среды вокруг частиц дисперсной фазы. Лиофильные системы термодинамически равновесные и характеризуются самопроизвольным диспергированием (дроблением одного вещества в другом). Так мыла самопроизвольно šраспускаютсяŸ в воде, а высокомолекулярные соединения растворяются в органических растворителях до отдельных макромолекул.
Лиофобные системы соответствуют слабому молекулярному взаимодействию дисперсной фазы и дисперсионной среды. Диспергируемое вещество инертно по отношению к дисперсионной среде. В лиофобных системах самопроизвольное диспергирование не происходит.
4.Классификация по фракционному составу частиц дисперсной фазы. В зависимости от однородности размеров дисперсных частиц выделяют две группы:
а) монодисперсные системы с частицами одинакового размера; б) полидисперсные системы с различными размерами дисперс-
ных частиц.
14
ГЛАВА 2. ТЕРМОДИНАМИКА И СТРОЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ
Межфазные поверхности могут существовать только при наличии в системе жидкой или твердой фазы. Именно они определяют форму и строение поверхностного слоя – переходной области от одной фазы к другой. Свойства поверхности непосредственно связаны с объемной структурой жидких и твердых фаз. Поверхностный слой жидкости вследствие подвижности молекулы в объеме, а также в результате процессов испарения и конденсации находится в состоянии непрерывного обновления. Плотность граничного слоя между водной фазой и ее насыщенным паром изменяется непрерывно от плотности жидкой воды до плотности ее пара. Внутренняя граница слоя соответствует началу изменения структуры жидкости в объеме.
Поверхность твердого тела в отличие от жидкости в течение долгого времени может оставаться без изменений. Вместе с тем многие твердые тела обладают пластическими свойствами и при определенных условиях могут течь, поэтому они могут характеризоваться объемной и поверхностной подвижностью.
Поверхностный слой на межфазных границах имеет одну часть в первой фазе, другую – во второй. Толщина поверхностного слоя обычно составляет несколько молекул. Всякая поверхность раздела резко отличается по своим физико-химическим свойствам (по плотности, электрической проводимости, составу, ориентации молекул) от внутренних частей обеих граничащих фаз. Различие это определяется тем, что на поверхности раздела фаз имеется избыток сво-
бодной поверхностной энергии Gs .
2.1. Свободная поверхностная энергия. Поверхностное натяжение
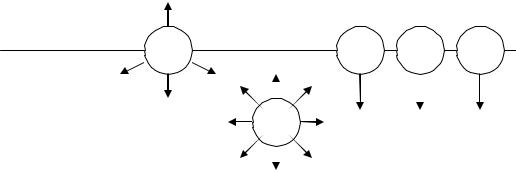
Гетерогенность дисперсной системы (присутствие межфазной поверхности) предполагает наличие поверхностного натяжения . Поверхностное натяжение определяет степень гетерогенности, резкость перехода от одной фазы к другой. Рассмотрим самый простой случай – поверхностное натяжение жидкости на границе с газом.
15
На молекулу, находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее молекул (рис. 2.1). Равнодействующая этих сил равна нулю вследствие симметрии силового поля и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Если же šвытащитьŸ молекулу на поверхность жидкости, то для нее не все силы молекулярного взаимодействия (сцепления) будут компенсированы.
f2
Газ
Жидкость
f1 |
R1 |
R2 R3 |
|
R=0
f1
Рис. 2.1. Изображение границы жидкость – газ
В газообразной фазе молекулы удалены друг от друга на большие расстояния, чем в жидкости, и действующие силы между ними ничтожны. Молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы ( f1), чем со стороны газообразной фазы ( f2 ). Результирующая сила Ri , пропорциональная разности ( f1 f2 ), направлена внутрь жидкости перпендикулярно к поверхности.
Сумма результирующих сил всех молекул, образующих единицу поверхности (1м2), называется внутренним или молекулярным давлением и обозначается PМ :
PМ R1 R2 R3 ... .
Это очень большая величина, PМ ( H 2O ) = 1400 атм. Таким об-
разом, на поверхности любой жидкости существует огромное давление, стремящееся затянуть все молекулы с поверхности внутрь жидкости. Этим объясняется форма мелких капель жидкости.

16
Чтобы создать новую поверхность раздела, например, растянуть жидкость в пленку, нужно затратить работу против сил молекулярного сцепления, т. е. совершить работу против сил внутреннего давления по переносу молекул из объема на поверхность. Работа образования поверхности, совершенная против сил внутреннего давления, пропорциональна площади поверхности s
W s . |
(2.1) |
Работа изотермического процесса, затраченная на образование единицы поверхности раздела фаз, называется поверхностным натяжением.
Поверхностный слой вследствие нескомпенсированности молекулярных сил имеет избыточную свободную энергию по сравнению с энергией объема жидкости. Избыток свободной энергии, отнесенный к единице поверхности, называется удельной свободной энергией и обозначается буквой (сигма). Величину называют также поверхностным натяжением.
С термодинамической точки зрения определение поверхностного натяжения вытекает из объединенного выражения первого и второго законов термодинамики для гетерогенной равновесной системы:
dG S d T Vdp d s i d ni d q . |
(2.2) |
При постоянных T , P , ni , q и составе равновесных фаз уравнение (2.2) принимает вид
dG ds , |
(2.3) |
отсюда
G
. (2.4)
s p,T ,ni ,q
Поверхностное натяжение есть частная производная от энергии Гиббса по площади раздела фаз при постоянных давлении, температуре, числе молекул компонентов и заряда q .
Так как объединенное уравнение первого и второго законов термодинамики может быть написано относительно других термо-
17
динамических потенциалов, то при соответствующих постоянных параметрах получим
U |
H |
A |
G |
. (2.5) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
s |
s |
|
|
|||||||||
|
S ,V ,n |
|
S , p,n |
|
s T ,V ,n |
|
s T , p,n |
|
||||
|
|
i |
|
|
i |
|
|
i |
|
|
i |
|
Таким образом, поверхностное натяжение есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответствующих параметрах. При протекании самопроизвольного процесса сжатия поверхности величина термодинамического потенциала уменьшается, т. е. его изменение отрицательно, изменение поверхности также отрицательно, поэтому значение поверхностного натяжения будет положительно. Из (2.3) получаем
|
W¦ §¨ |
|
||
dG ds W¦ §¨ или |
|
. |
(2.6) |
|
s |
||||
|
p,T |
|
||
При уменьшении или сокращении поверхности совершается положительная работа, при образовании – отрицательная.
Изменение энергии Гиббса поверхности можно представить через энергию Гиббса, приходящуюся на единицу площади поверх-
ности Gs , т. е. |
|
|
G Gs s |
|
|
|
(2.7) |
|
|
|
|
|
|
||
|
|
dG d Gs s , |
|
|
(2.8) |
||
G |
|
G |
|
|
|
||
|
|
|
Gs s |
s |
|
. |
(2.9) |
|
s |
||||||
|
s p,T ,n |
|
p,T ,n |
|
|
||
|
|
i |
|
|
i |
|
|
Термодинамические потенциалы единицы поверхности не изменяются с изменением площади поверхности для индивидуальных веществ Gs / s 0 . Это значит, что поверхностное натяжение ин-
дивидуальных веществ является в то же время удельной энергией Гиббса поверхности (энергией Гиббса, приходящейся на единицу площади поверхности), т. е. для индивидуальных веществ
18 |
|
Gs . |
(2.10) |
Поверхностное натяжение на границе жидкости с газовой средой можно представить как работу, расходуемую на обратимый разрыв столбика этой жидкости с поперечным сечением в 1/2 единицы площади, так как при разрыве образуется новая поверхность, равная единицы площади.
Чем сильнее межмолекулярные связи в данном теле, тем больше его поверхностное натяжение на границе с газовой фазой. Отсюда следует, что поверхностное натяжение меньше у неполярных жидкостей, имеющих слабые межмолекулярные связи, и больше у полярных жидкостей. Большим поверхностным натяжением обладают вещества, имеющие межмолекулярные водородные связи, например вода.
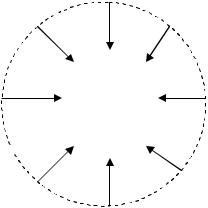
Есть и другой смысл поверхностного натяжения. Физическая сущность поверхностного натяжения в этом случае проявляется в том, что поверхностные молекулы, обладая избыточной (нескомпенсированной) энергией, стремятся уйти вглубь конденсированной фазы и тем самым сжимают поверхность. Действие поверхностного
Рис. 2.1. Схема действия сил поверхностного натяжения
натяжения можно наглядно представить в виде действия совокупности сил, стягивающих края поверхности, ограниченной контуром к центру. Эти силы изображены на рис. 2.1 стрелками – векторами; длина стрелок отражает величину поверхностного натяжения, а рас-

19
стояние между ними соответствует принятой единицы длины этого контура.
Единицы измерения поверхностного натяжения. Поскольку поверхностное натяжение определяется энергией, приходящейся на единицу площади, то в системе СИ размерность поверхностного на-
Дж Hм Н
тяжения м2 м2 м .
2.2 Методы определения поверхностного натяжения
Поверхностное натяжение определяют экспериментально несколькими методами. В основе многих методов лежит измерение энергии и силы разрыва межмолекулярных связей.
1) Самый простой метод – метод счета капель. В сталагмометр (пипетку с плоскошлифованными краями) до метки набирают исследуемую жидкость. По мере вытекания жидкости считают число капель. Аналогично определяют число капель для жидкости с известным поверхностным натяжением. Предполагается, что отрыв капли происходит в тот момент, когда ее масса становится равной силам поверхностного натяжения, действующим вертикально по окружности трубки. Поверхностное натяжение рассчитывают по уравнению
0 |
n0 |
, |
(2.11) |
|
|||
|
0 n |
|
|
где , , n поверхностное натяжение, плотность и число капель исследуемой жидкости; 0 , 0 , n0 то же самое для жидкости с известным значением поверхностного натяжения.
2) Метод максимального давления пузырьков. В этом методе поверхностное натяжение определяется по величине давления p , при котором происходит отрыв пузырька воздуха, радиусом R . Пузырек воздуха отрывается в тот момент, когда давление воздуха в капилляре ( p ) становится равным сумме гидростатического давления столба жидкости и капиллярного давления. Гидростатическое давление соответствует глубине погружения капилляра h , капиллярное давление действует на вогнутую поверхность жидкости (рис 2.2).

20
h
R
Рис. 2.2. К методу максимального давления пузырька
Сначала в сосуд заливают жидкость, поверхностное натяжение которой известно. Экспериментально с помощью манометра определяют p0 , пуская ток пузырьков воздуха; p0 – это давление, при котором происходит отрыв пузырьков воздуха от капиллярного кончика, погруженного в жидкость с известным значением поверхностного натяжения 0 . Затем наливают исследуемую жидкость и также измеряют давление p , при котором происходит отрыв пузырьков воздуха. Рассчитывают поверхностное натяжение по уравнению
|
0 p |
. |
(2.12) |
|
|||
|
p0 |
|
|
2.3. Факторы, влияющие на поверхностное натяжение
1) Химическая природа вещества.
Самое низкое поверхностное натяжение имеют сжиженные инертные газы, у гелия оно равно 0,2 мДж/м2 (мДж – миллиджоуль). У органических веществ и воды поверхностное натяжение составляет 20 – 100 мДж/м2. Самые высокие значения характерны для металлов с высокой температурой плавления, у алмаза поверхностное натяжение порядка 104 мДж/м2. Для многих веществ поверхностное натяжение вблизи температуры плавления пропорционально теплоте плавления.
2) Природа граничащих фаз. Термин šповерхностное натяжениеŸ используют, прежде всего, для характеристики границы раздела жидкость – газ и твердое тело – газ. Для поверхностей раздела конденсированных фаз (ж – ж, т – ж) часто применяют другой термин – межфазное натяжение. Межфазное натяжение равно работе
