
Поверхностные явления и дисперсные системы
.pdf41
Гиббсовская адсорбция Г определяется избытком вещества в поверхностном слое определенной толщины по сравнению с его количеством в таком же объеме фазы. Все величины отнесены к единице поверхности или единице массы адсорбента (метод избыточных величин Гиббса). Гиббсовская адсорбция описывается уравнениями
Г |
n |
; |
(3.4) |
|
|
||||
|
s |
|
||
Г |
n |
, |
(3.5) |
|
|
||||
|
m |
|
||
где n – избыток молей вещества в поверхностном слое по сравнению с объемом фазы.
Обозначим cV - равновесную концентрацию компонента в объеме после адсорбции, тогда n cs cV Vs cs cV sh , подставляем это выражение в уравнение (3.4), получаем после сокра-
щения и раскрытия скобок |
|
´ cs h cV h . |
(3.6) |
Сравнивая уравнения (3.3) и (3.6) получаем соотношение между абсолютной адсорбцией и гиббсовской
|
´ A cV h . |
|
|
(3.7) |
||
Для экспериментальных расчетов гиббсовской адсорбции ис- |
||||||
пользуют уравнение |
|
c0 |
cV V |
|
|
|
´ |
c0 cV V |
или ´ |
, |
(3.8) |
||
s |
|
|
||||
|
|
|
m |
|
||
где c0 ,cV – исходная концентрация вещества в объеме до адсорбции и равновесная после адсорбции; V – объем фазы, из которого происходит адсорбция (объем раствора с адсорбентом); s – поверхность раздела фаз; m – масса адсорбента.
3.1.1 Классификация адсорбции
Процессы адсорбции классифицируют в соответствии с типом взаимодействия адсорбата с адсорбентом. Физико-химическая клас-
42
сификация основывается на том положении, что перераспределение компонентов между объемной фазой и поверхностным слоем может происходить под действием физических сил или в результате химической реакции между адсорбатом и адсорбентом. Химическую реакцию в этом случае можно представить либо как присоединение атомов (молекул), либо как ионообменное взаимодействие. Таким образом, различают физическую (молекулярную) адсорбцию, хемосорбцию (химическое присоединение атома, молекулы) и ионный обмен.
При физической адсорбции взаимодействие адсорбата и адсорбента осуществляется за счет сил ван-дер-ваальса и водородных связей, на очень близких расстояниях возникают короткодействующие силы отталкивания. Физическая адсорбция характеризуется отсутствием стехиометрических соотношений, уменьшением адсорбции с ростом температуры. Энергия активации составляет 10 – 40 кДж/моль. Физическая адсорбция отличается универсальностью и малой специфичностью взаимодействия. При физической адсорбции могут иметь место как нелокализованная, так и локализованная
адсорбции. При нелокализованной адсорбции молекулы адсорбата могут перемещаться по поверхности адсорбента, при локализованной не могут. Физическая адсорбция протекает самопроизвольно, этот процесс является динамическим: наряду с адсорбцией идет обратный процесс – десорбция, при которой адсорбированные молекулы удаляются с поверхности адсорбента. Со временем скорость адсорбции уменьшается, а скорость десорбции возрастает. Это происходит до тех пор, пока не наступит адсорбционное равновесие, при котором обе скорости станут одинаковыми wадс wдесорб .
Химическая адсорбция (или хемосорбция) обусловлена силами химической природы между адсорбатом и адсорбентом. При химической адсорбции может теряться индивидуальность исходных компонентов. Хемосорбция требует энергии активации 40 – 400 кДж/моль, поэтому повышение температуры способствует хемосорбции. Хемосорбция характеризуется специфичностью взаимодействия, приводящего к образованию поверхностного химического соединения, поэтому это часто локализованная адсорбция. Так как химическая адсорбция обусловлена образованием связей, близких к химическим, хемосорбция почти необратима и десорбция идет с большим трудом. Следует подчеркнуть, что явления физической и
43
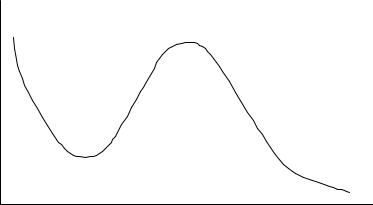
химической адсорбции различаются лишь в крайних случаях. Обычно осуществляются промежуточные варианты адсорбции, когда основная масса адсорбированного вещества связывается сравнительно слабо с адсорбентом (физическая адсорбция), и лишь небольшая часть связывается прочно (химическая адсорбция). Влияние температуры на величину адсорбции представлено на рис. 3.1.
A |
1 |
|
3 |
|
|
Физическая |
|
||
|
|
|
||
|
|
|
|
|
|
|
адсорбция |
|
|
|
|
|
Хемосорб- |
Десорбция и |
|
|
|
разложение |
|
|
|
|
ция |
|
|
|
|
вещества |
|
|
|
2 |
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
T |
Рис. 3.1. Влияние температуры на процесс адсорбции водорода на никеле: линия 1-2 – физическая адсорбция; линия 2-3 – хемосорбция; линия 3-4 – десорбция.
При низких температурах адсорбция протекает по законам физической адсорбции, но при повышении температуры адсорбция становится химической и количество адсорбированного вещества начинает возрастать с ростом температуры. В области высоких температур наблюдается вновь уменьшение количества адсорбированного вещества в результате активно протекающей десорбции и разложения адсорбированного вещества.
3.1.2. Зависимости адсорбции от различных параметров
При установлении адсорбционного равновесия в системе количество адсорбированного вещества в поверхностном слое находится в определенной зависимости от концентрации (от парциального давления) вещества в объеме и от температуры. Относительно величины адсорбции A уравнение состояния адсорбционной системы имеет следующий вид
44 |
|
A f c,T p,T , |
(3.9) |
где c, p – соответственно равновесная концентрация и парциальное давление адсорбата; T – температура.
Из уравнения (3.9) следует, что возможны три вида зависимости параметров системы. Зависимость величины адсорбции от концентрации (или парциального давления) вещества при постоянной температуре называется изотермой адсорбции (наиболее распространенная зависимость, так как проще всего поддерживать постоянной температуру)
A fT c T p . |
(3.10) |
Зависимость величины адсорбции от температуры при постоянной концентрации (или парциальном давлении) вещества называется изопикной (или изобарой) адсорбции:
A fc T c T . |
(3.11) |
Зависимость концентрации (или парциального давления) вещества в объеме от температуры при постоянной величине адсорбции называется изостерой адсорбции
c f A T |
или p A T . |
(3.12) |
3.3 Фундаментальное адсорбционное уравнение Гиббса
В результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностным слоем, что влечет за собой изменение их химических потенциалов. Поэтому процесс адсорбции можно рассматривать как превращение поверхностной энергии в химическую энергию. Выведем соотношение между поверхностным натяжением и химическими потенциалами компонентов системы.
Объединенное уравнение первого и второго законов термодинамики для внутренней энергии
45
dU TdS pdV ds i dni dq . |
(3.13) |
i |
|
Если объем поверхностного слоя равен нулю, то pdV 0; если нет заряженных частиц, то dq 0 , получаем
dU TdS ds idni . |
(3.14) |
i |
|
Так как внутренняя энергия поверхности пропорциональна экстенсивным величинам, то
U TS s i ni . |
(3.15) |
i |
|
Полный дифференциал внутренней энергии от тех же переменных
dU TdS SdT ds sd i dni ni d i . |
(3.16) |
|
i |
i |
|
Подставляя значение dU из уравнения |
(3.14) в уравнение |
|
(3.16), после сокращения получим |
|
|
SdT sd ni d i 0 . |
|
(3.17) |
i |
|
|
При постоянной температуре уравнение (3.17) принимает вид |
|
|
sd nid i 0 . |
|
(3.18) |
i |
|
|
Уравнения (3.17) и (3.18) называются уравнениями Гиббса для межфазной поверхности (поверхностного слоя).
Все экстенсивные величины поверхности: внутренняя энергия, энтропия, число молей компонентов – зависят от площади поверхности s , поэтому удобнее относить эти параметры к единице площади поверхности. Разделим уравнение (3.18) на площадь поверхности
|
|
|
d |
ni |
d 0 . |
(3.19) |
|
|
|
|
|
||||
|
|
|
i s |
i |
|
||
|
ni |
|
|
|
|||
Так как |
´ |
– поверхностный избыток компонента i в поверх- |
|||||
|
|||||||
|
s |
i |
|
|
|||
|
|
|
|
|
|
||
ностном слое (по сравнению с его равновесной концентрацией в объемной фазе), приходящийся на единицу поверхности, то это ве-
46
личина гиббсовской адсорбции. С учетом этого выражения уравнение (3.19) примет вид
d ´id i . |
(3.20) |
i |
|
Уравнение (3.20) называется фундаментальным адсорбционным уравнением Гиббса. В этом уравнении единицы величины гиббсовской адсорбции определяются единицами химического потенциала. Если потенциал отнесен к молю вещества, то величина адсорбции выражается в молях на единицу площади. Далее это уравнение будет использовано для выводов уравнений адсорбции различных типов. Фундаментальное уравнение Гиббса устанавливает связь между гиббсовской адсорбцией и изменением поверхностного натяжения.
3.4. Адсорбция на границе раствор – газ
Граница раздела фаз жидкость – газ гладкая и однородная, поэтому в данном случае нельзя использовать представления об активных центрах. Силы взаимодействия со стороны газовой и жидкой фазы неодинаковы и силовым полем в одной из объемных фаз (газовой) можно пренебречь, молекулы адсорбата могут свободно перемещаться по поверхности раздела. Так как поверхностный слой формируется в результате самопроизвольного уменьшения поверхностной энергии, а поверхностная энергия определяется уравнением
G s s , то на поверхности оказывается то вещество, которое обеспечивает наименьшее поверхностное натяжение , возможное в данных условиях. Так при растворении ПАВ в воде на поверхности оказываются молекулы ПАВ, а при растворении в воде ПИВ на поверхности оказываются молекулы воды.
Процесс перехода молекул ПАВ из объемной фазы в поверхностный слой пойдет самопроизвольно в сторону уменьшения до тех пор, пока не будет компенсироваться встречным процессом диффузии, обусловленным разностью концентраций компонента в поверхностном слое и объеме фазы. Таким образом, в состоянии равновесия значения концентрации в поверхностном слое и объеме фазы будут разными. Здесь мы встречаемся с удивительным процессом, в котором интенсивные величины (концентрация) в самопроизвольном процессе не выравниваются, как обычно, а наоборот
расходятся и в состоянии равновесия nis 0, |
cis ciV . |
47
Это различие концентраций в поверхностном слое и в объеме раствора приводит к возникновению сил осмотического давления и процессу диффузии, стремящемуся выровнять концентрации по всему объему, что влечет за собой изменение химических потенциалов компонентов в системе. Когда химический потенциал растворенного вещества и растворителя в поверхностном слое равны их химическим потенциалам в объеме раствора, то в системе наступает подвижное равновесие, которое характеризуется минимумом свободной энергии всей системы в целом и определенной разностью концентраций между поверхностным слоем и объемом раствора ni nis nVi .,
Избыток растворенного вещества ( ni ), отнесенный к единице
поверхности, и называют гиббсовской адсорбцией ´i |
|
|||
Гi |
|
ni |
. |
(3.21) |
|
||||
|
|
s |
|
|
3.4.1. Уравнение изотермы адсорбции Гиббса
Для описания зависимости адсорбции каждого конкретного вещества от поверхностного натяжения при постоянных химических потенциалах других веществ, запишем уравнение (3.20) относительно частной производной для данного компонента
|
|
|
|
|
|
|
||
´i |
|
|
. |
|
|
(3.22) |
||
|
|
|
|
|||||
|
|
|
i j |
|
|
|
||
Принимая во внимание, что |
i |
0 |
RT ln a |
, (где |
, 0 |
– равно- |
||
|
|
i |
|
i |
|
i i |
|
|
весное и стандартное значение химического потенциала адсорбата i ; ai – термодинамическая активность адсорбата), получаем d i RTd ln ai , подставляем это выражение в уравнение (3.22)
´ |
1 |
|
|
|
|
|
(3.23) |
||||
RT |
|
ln a |
|
||||||||
i |
|
||||||||||
или |
|
|
|
|
|
|
i |
j |
|
||
|
|
|
|
|
|
|
|
|
|
||
´ |
ai |
|
|
|
. |
(3.24) |
|||||
|
|
|
|
|
|
||||||
RT |
|
|
a |
||||||||
i |
|
|
|
||||||||
|
|
|
|
|
|
|
i j |
|
|||

48
Уравнение (3.24) называется уравнением изотермы адсорбции Гиббса. Активность компонента можно выразить через концентрацию и коэффициент активности i : ai ici . Для разбавленного раствора данного компонента имеем i 1 и ai ci . Получаем широко используемое адсорбционное уравнение Гиббса для неэлектролитов
´ |
ci |
|
|
. |
(3.25) |
RT |
|
|
|||
i |
c |
|
|||
|
|
|
i j |
|
|
Если в растворе присутствует только одно растворенное вещество, то уравнение имеет вид
Г |
c |
|
d |
. |
(3.26) |
|
|
||||
|
RT dc |
|
|||
Это уравнение отражает связь между гиббсовской адсорбций растворенного вещества и изменениями поверхностного натяжения.
Если адсорбция происходит из газовой фазы, то выразив концентрацию в соответствии с уравнением Менделеева – Клапейрона
( pV nRT , |
p |
n |
RT cRT ; |
c |
|
p |
), получаем |
|
|||
|
|
|
|
|
|||||||
|
V |
|
|
RT |
|
||||||
|
|
|
Г |
|
p |
|
d |
. |
(3.27) |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
RT dp |
|
|||||
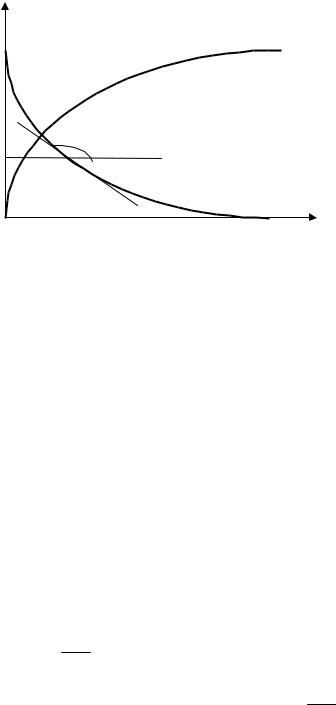
Из полученных уравнений следует, что, зная зависимость поверхностного натяжения раствора от концентрации (давления пара), можно рассчитать и построить изотерму адсорбции этого компонента (рис. 3.2).
В нескольких точках кривой =f(c) проводят касательные и определяют тангенсы угла наклона их к оси абсцисс (tg ), которые
соответствуют значениям производных в этих точках d tg . dc
С учетом знака минус в формуле (3.26) получаем
d tg tg Z . dc
49
, ´
0 ´ f c
f c
c
Рис. 3.2. Построение изотермы адсорбции ´ f c по изотерме поверхностного натяжения f c
Зная производные в точках, соответствующих определенным значениям концентраций, можно рассчитать величину гиббсовской адсорбции по уравнению
´ |
cZ |
(3.28) |
|
RT |
|||
|
|
и построить изотерму адсорбции.
3.4.2. Поверхностная активность. Правило Дюкло – Траубе.
Из адсорбционного уравнения Гиббса (3.26) следует, что направление процесса, т. е. концентрирование вещества в поверхностном слое или, наоборот, переход его в объемную фазу определяется
знаком производной d . Эта производная определяет и знак гиб- dc
бсовской адсорбции. Таким образом, величина d может служить dc
характеристикой поведения вещества при адсорбции. Чтобы исключить влияние концентрации на производную, берут ее предельное значение при c 0. Эту величину П.А. Ребиндер назвал поверхностной активностью( g )
d |
|
|
||
g |
|
|
. |
(3.29) |
|
||||
|
dc c 0 |
|
|
|

50
Если с увеличением концентрации вещества поверхностное
натяжение уменьшается (что характерно для ПАВ), т. е. если d < dc
0, то Г > 0 (положительная адсорбция). Пределом положительной адсорбции служит полное насыщение поверхностного слоя молекулами растворенного вещества.
Если поверхностное |
натяжение увеличивается с ростом кон- |
|
центрации, т. е. если |
d |
> 0, то Г < 0 (отрицательная адсорбция). |
|
||
dc
Иначе говоря, концентрация растворенного вещества в поверхностном слое меньше, чем в объеме. Если поверхностное натяжение не
зависит от концентрации, то d = 0, Г = 0 (адсорбция отсутствует). dc
Два последних случая наблюдаются при растворении ПИВ. С увеличением концентрации ПИВ в объеме, растет отрицательная величина гиббсовской адсорбции (рис. 3.3)
Уравнение (3.29) показывает, что чем сильнее уменьшается поверхностное натяжение с увеличением концентрации, тем больше поверхностная активность этого вещества. Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и рассчитанную на единицу гиббсовской адсорбции.
a |
|
б |
|
Г |
ПАВ |
|
||
|
ПИВ |
|
|
|
ПАВ
ПИВ
c
c
Рис. 3.3. Зависимость поверхностного натяжения (а) и гиббсовской адсорбции (б) от концентрации поверхностноактивного и поверхностно-инактивного вещества в растворе.
