
Поверхностные явления и дисперсные системы
.pdf
31
2
2

 1 3
1 3
3
Рис. 2.6. К выводу соотношения между работой адгезии и поверхностными натяжениями взаимодействующих компонентов.
Обозначение фаз: 1 – газ; 2 – жидкость; 3 – твердое
Фаза 3 может быть жидкостью, которая не смешивается с жидкостью 2. В результате работы разрыва исчезает граница раздела 2– 3, которая имела удельную поверхностную энергию 2,3 , при раз-
рыве эта энергия исчезает. При возникновении двух новых поверхностей 1–2 и 1–3 в систему добавляется две удельные поверхностные энергии 1,2 и 1,3 . Из закона сохранения энергии следует
2,3 Wa 1,2 1,3 . |
(2.33) |
Отсюда работа адгезии определяется уравнением
Wa 1,2 1,3 2,3. |
(2.34) |
Это уравнение Дюпре. Если перейти к конкретным фазам, то в соответствии с обозначением получаем
Wa ³´ µ´ µ³ . |
(2.35) |
Работа адгезии – работа, затраченная на преодоление сил сцепления между молекулами разных фаз и приводящая к появлению 1м2 поверхности с воздухом каждой из них.
Из уравнения Дюпре следует, что работа адгезии тем больше, чем больше поверхностное натяжение образовавшихся поверхностей и меньше исходное межфазное натяжение.

32
Размерность когезии и адгезии выражается в единицах по-
верхностного натяжения Дж . м2
2.8.3. Механизм процессов адгезии.
Процесс образования адгезионной связи делят на две стадии.
Первая стадия – транспортная стадия, на ней происходит перемещение молекул адгезива (клеящего вещества, связующего) к поверхности субстрата (тело, на которое наносится адгезив). Далее происходит определенное ориентирование молекул адгезива в межфазном слое, в результате чего обеспечивается тесный контакт между молекулами и функциональными группами молекул адгезива и субстрата. Протеканию первой стадии процесса адгезии способствуют повышение температуры и давления, а также перевод одной из фаз (обычно адгезива) в жидкое состояние растворением или плавлением.
Вторая стадия состоит в непосредственном взаимодействии адгезива и субстрата, которое обусловлено различными силами – от ван-дер-ваальсовых сил до химических сил. Межмолекулярным взаимодействием контактирующих фаз завершается процесс адгезии, что соответствует минимальной межфазной (поверхностной) энергии. При склеивании твердых тел на этой стадии происходит затвердевание адгезива. Максимальная адгезия твердых тел недостижима из-за неровностей поверхностей.
Различают несколько механизмов адгезии в зависимости от природы взаимодействующих тел и условий адгезии:
1.Механическая адгезия осуществляется путем затекания в поры и трещины поверхности твердого тела жидкого адгезива. Адгезив затвердевает, обеспечивая механическое зацепление с твердым телом.
2.Молекулярный (адсорбционный) механизм. Согласно этому механизму адгезия возникает под действием молекулярных ван-дер- ваальсовых сил и водородных связей. В этом механизме работает правило: чем ближе по полярности адгезив и субстрат, тем более прочный контакт между ними. В этой теории адгезия рассматривается как поверхностный процесс, в котором решающее значение имеет адсорбция молекул вещества (адгезива) на определенных участках твердого субстрата.
33
3.Электрическая теория связывает адгезию с возникновением двойного электрического слоя на границе раздела между адгезивом и субстратом. Отслаивание, как и раздвижение обкладок конденсатора, вызывает увеличение разности электрических потенциалов, которое обусловливает прочность адгезионного контакта.
4.Диффузионная теория. Диффузионный механизм связывает возникновение адгезионной прочности с взаимной диффузией адгезива и субстрата. Процесс диффузии приводит к размыванию границы раздела фаз, взаимному растворению в местах контакта.
5.Механизм, обусловленный химическим взаимодействием адгезива и субстрата при адгезии.
Вконкретных условиях один из механизмов может преобладать, но чаще механизм адгезии является смешанным.
2.8.3. Смачивание
Смачивание – физико-химическое явление, происходящее при контакте жидкостей с поверхностью твердого тела. Важнейшая особенность смачивания заключается в том, что в процессе участвуют три разные фазы. Первая фаза – это твердое тело, вторая фаза – смачивающая жидкость, третья фаза – это фаза, с которой граничила твердая фаза до подвода к ее поверхности смачивающей жидкости. Третьей фазой часто является газ (воздух). В технике бывают случаи, когда третья фаза – это другая жидкость, которая не смешивается со смачивающей жидкостью.
Смачивание – это поверхностное явление, заключающееся во взаимодействии жидкости с твердым телом или другим жидким телом при одновременном контакте трех несмешивающихся фаз, одна из которых обычно является газом (воздухом).
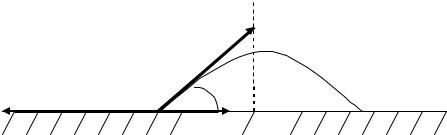
При нанесении небольшого количества жидкости (например, капли) на поверхность твердого тела или другой жидкости можно наблюдать два случая, если приводимые в контакт вещества взаимно нерастворимы. В одном случае нанесенная жидкость остается на поверхности в виде капли, принявшей при установившемся равновесии определенную форму. В другом случае капля растекается по поверхности. Рассмотрим первый случай (рис. 2.7). Рисунок иллюстрирует состояние капли жидкости на поверхности твердого тела в условиях равновесия.
34
|
газ |
ЖГ |
|
ТГ |
О |
|
жидкость |
|
|
ТЖ |
А |
твердое тело |
|
|
|
Рис. 2.7. К выводу уравнения для краевого угла. Равновесие сил поверхностного натяжения.
Линия, по которой поверхность раздела газ – жидкость соприкасается с поверхностью твердого тела, называется периметром смачивания.
На единицу длины периметра смачивания действуют три силы. Поверхностная энергия твердого тела, стремясь уменьшиться, растягивает каплю по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом ТГ . Межфазная энергия на границе твердого тела с жидкостью ТЖ стремится, наоборот, сжать каплю, т. е. поверхностная энергия на границе твердое тело – жидкость уменьшается за счет снижения площади поверхности. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между твердой и газообразной фазами по касательной к сферической поверхности капли и равно ТЖ .
Угол , образованный касательными к межфазным поверхностям, ограничивающим смачивающую жидкость, и имеющий вершину на линии раздела трех фаз, называется краевым углом или углом смачивания. Угол отсчитывается в сторону жидкости. Степень смачивания количественно характеризуется безразмерной величиной косинуса краевого угла (угла смачивания) или просто краевым углом (углом смачивания).
Так как поверхностное натяжение можно рассматривать как энергию, приходящуюся на единицу длины, то все эти составляющие поверхностной энергии можно выразить с помощью векторов сил. Произведение ³´ cos есть проекция вектора ЖГ на горизонтальную плоскость (отрезок ОА).
35
При равновесии наблюдается соотношение, которое называется уравнением Юнга
µ´ µ³ ³´ cos . |
(2.36) |
Чем лучше смачивание, тем меньше угол смачивания и тем больше косинус угла смачивания.
В зависимости от значений равновесного краевого угла различают три основных вида смачивания:
1)несмачивание (плохое смачивание) – краевой угол тупой, т.
е.180¾ > >90¾ (например, вода на парафине);
2)смачивание (ограниченное смачивание) – краевой угол острый, т. е. 90¾ > >0¾ (например, вода на металле);
3)полное смачивание – равновесный краевой угол не устанавливается, капля растекается в тонкую пленку (например, вода на кварце).
Границей между смачиваемостью и несмачиваемостью является угол = 90¾ или cos = 0.
Из анализа формулы Юнга видно, что смачиванием можно управлять, изменяя поверхностное натяжение.
Для сравнительной оценки обычно производят сопоставление смачиваемости поверхностей различными жидкостями по сравнению с водой. Если между нанесенными на поверхность каплями воды и жидкого углеводорода краевой угол меньше 90¾ со стороны воды, то поверхность называют гидрофильной (или олефобной). Если же краевой угол меньше 90¾ со стороны неполярного углеводорода, то поверхность будет гидрофобной (или олефильной).
2.8.4. Связь работы адгезии с краевым углом
Уравнение Дюпре Wa ³´ µ´ µ³ самостоятельно почти не используют для расчета работы адгезии, так как трудно определить ТГ , ТЖ . Удобную формулу для расчета этой величины имеет соотношение, полученное в результате сочетания уравнения Дюпре с уравнением Юнга (2.36). Если разность µ´ µ³
вуравнении Дюпре заменить ее выражением из закона Юнга
µ´ µ³ ³´ cos , получим

36 |
|
W ³´ (1 cos ) . |
(2.37) |
Полученное уравнение называют уравнением Дюпре – Юнга, оно связывает работу адгезии с краевым углом и позволяет рассчитать работу адгезии, если известно поверхностное натяжение жидкости и краевой угол. При увеличении работы адгезии увеличивается смачивание. Преобразуем уравнение (2.37)
|
|
Wa |
1 cos . |
(2.38) |
||||
³´ |
||||||||
|
|
|
|
|||||
Разделим обе части уравнения на 2, с учетом, что 2 ³´ W» , по- |
||||||||
лучим |
|
|
|
|
||||
|
|
Wa |
|
1 cos |
. |
(2.39) |
||
|
|
|
||||||
|
|
W» |
2 |
|
|
|||
Так как смачивание количественно характеризуется косинусом краевого угла, то в соответствии с уравнением (2.39) оно определяется отношением работы адгезии к работе когезии для смачивающей жидкости. Принципиальное различие между поверхностными явлениями адгезии и смачивания состоит в том, что смачивание имеет место при наличии трех сопряженных фаз.
Из уравнения (2.39) можно сделать следующие выводы: 1) при 0, cos 1, Wa W» , смачивание полное;
2) при 90 , cos 0, Wa 1 W» , граница между смачиванием и 2
несмачиванием;
3) при 180 , cos 1, Wa 0 , полное несмачивание. Такое состояние на практике не реализуется, так как некоторая адгезия всегда существует.
Из уравнения (2.39) следует, что для увеличения смачивания, т.е. для уменьшения краевого угла и увеличения косинуса краевого угла, нужно увеличить работу адгезии или уменьшить работу коге-
37
зии (поверхностное натяжение жидкости), например введением ПАВ, изменением температуры.
2.8.5. Инверсия смачивания
Инверсия смачивания – это качественное изменение смачивания за счет адсорбции ПАВ на твердой поверхности. Наиболее эффективным методом является ведение ПАВ в жидкую фазу или предварительная обработка твердой поверхности растворами ПАВ. Таким путем можно не только влиять на величину смачивания, но и вызывать его инверсию. Путем добавления ПАВ удается гидрофилизировать гидрофобные поверхности, и вызывать их смачивание водой и другими полярными жидкостями, либо предавать гидрофобные свойства первоначально гидрофильной поверхности и делать ее плохо смачиваемой водой.
cos |
хорошее смачивание, |
|
|
||
|
90 |
|
|
A |
90 |
0 |
|
CПАВ |
cos |
плохое смачивание, |
|
90 |
||
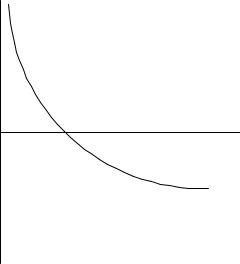
Рис. 2.8. Инверсия смачивания |
||
Адсорбция ПАВ на твердой поверхности влияет не только на величину cos , но и на ее знак. Зависимость косинуса краевого угла при постоянной температуре от концентрации ПАВ называется изотермой смачивания. На рисунке 2.8 показано, что с ростом концентрации ПАВ ранее гидрофильная поверхность становится гидрофобной. Изотерма смачивания пересекает ось абсцисс в точке A
– точке инверсии смачивания, которая соответствует концентрации ПАВ, при которой происходит изменение знака cos .
38
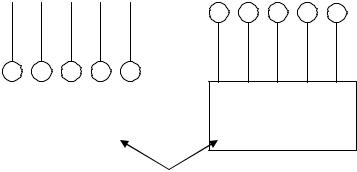
Механизм инверсии смачивания связан с определенной ориентацией молекул ПАВ в адсорбционном слое. Если твердая поверхность первоначально гидрофильна, то адсорбированные молекулы взаимодействуют своими полярными группами с поверхностью, а неполярными обращаются наружу, вследствие чего твердая поверхность становится гидрофобной (рис.2.9 а).
жидкость
|
|
|
|
|
а) |
твердое тело |
б) |
||
|
|
|||
Рис. 2.9. а) гидрофобизация поверхности; б) гидрофилизация поверхности.
В противоположном случае, когда твердая поверхность гидрофобна, адсорбированные на ней молекулы ПАВ (дифильные) обращаются к твердому телу своими углеводородными цепями, а полярными группами наружу. Поверхность становится гидрофильной (рис.2.9. б).
Инверсия смачивания находит практическое применение, например, моющее действие ПАВ связано с улучшением смачивания загрязненных поверхностей и тканей за счет адсорбции ПАВ и понижения поверхностного натяжения раствора.
Важной характеристикой смачивания является теплота смачивания особенно при изучении процессов смачивания порошков или пористых материалов, где изменение краевого угла затруднено.
Интегральная теплота смачивания измеряется количеством энергии (работы) отнесенной к единице поверхности (Дж/м2). При смачивании всегда выделяется теплота, т.е. она отрицательна.
2.8.6. Флотация
Флотация относится к наиболее распространенным методам обогащения полезных ископаемых: руды цветных металлов, угля,
39
графита, серы, кальцита, флюорита, барита и др. Флотационное обогащение (разделение) основано на различной смачиваемости водой ценных минералов и пустой породы. В настоящее время используют пенную и масляную флотацию. Наиболее распространенной является пенная флотация. В этом методе обогащения через водную суспензию измельченной руды (пульпу) барботируют воздух. К пузырькам воздуха прилипают за счет адгезии гидрофобные частицы ценного материала, которые затем всплывают на поверхности воды и с образовавшейся пеной снимаются механически для дальнейшей переработки. Пустая порода хорошо смачивается водой и оседает во флотационных машинах.
ГЛАВА 3. АДСОРБЦИОННЫЕ РАВНОВЕСИЯ
3.1. Основные понятия и определения
Адсорбция – это явление, происходящее вследствие стремления поверхностной энергии системы самопроизвольно уменьшать-
ся. Так как поверхностная энергия G s s , то уменьшение поверхностной энергии возможно за счет уменьшения площади раздела фаз и за счет уменьшения поверхностного натяжения. При адсорбции уменьшается поверхностное натяжение. В поверхностный слой предпочтительнее переходит тот компонент, который сильнее уменьшает поверхностное натяжение. Если система однокомпонентная, то при формировании поверхностного слоя происходит изменение его структуры (сгущение, уплотнение), которое называется автоадсорбцией.
Адсорбцией называется сгущение газообразного или растворенного вещества на поверхности раздела фаз, которое происходит в результате самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой.
Адсорбция может быть результатом химического взаимодействия компонента с поверхностью вещества (хемосорбция), и тогда поверхностная энергия может даже возрастать на фоне уменьшения энергии всей системы.
Адсорбция происходит на границе раздела фаз. То вещество (имеющее более плотную фазу), на поверхности которого идет адсорбция, принято называть адсорбентом. Адсорбент может быть
40
твердым или жидким. Вещество, которое перераспределяется (адсорбируется) на границе раздела фаз, называется адсорбатом (адсорбтивом). Это вещество обычно находится в газообразной или жидкой фазе.
Если поглощаемое вещество диффундирует вглубь поглотителя и распределяется по объему, то это явление называется абсорбцией.
В зависимости от агрегатного состояния смежных фаз различают следующие виды адсорбции:
1)адсорбция газов на твердых адсорбентах;
2)адсорбция на границе жидкий раствор – газ;
3)адсорбция растворенных веществ на границе твердое тело – жидкость и жидкость – жидкость.
Для количественного описания адсорбции применяют в основном две величины.
Абсолютная величина адсорбции А (метод слоя конечной толщины) измеряется количеством адсорбата (числом молей или граммов) в поверхностном слое, приходящемся на единицу площади поверхности или единицу массы адсорбента. Абсолютная величина адсорбции рассчитывается по уравнениям
A |
ns |
; |
(3.1) |
|
|||
|
s |
|
|
A |
ns |
, |
(3.2) |
|
|||
|
m |
|
|
где ns – число молей адсорбата в поверхностном слое; s – площадь межфазной поверхности, м2; m – масса адсорбента, кг.
Абсолютная величина адсорбции всегда является положительной величиной. Обозначим h толщину поверхностного слоя, тогда объем поверхностного слоя будет равен Vs sh , а число молей адсорбата ns csVs cs sh , где cs – концентрация компонента в поверхностном слое. Подставляем полученное выражение в уравнение
(3.1) и получаем |
|
A csh . |
(3.3) |
