
Поверхностные явления и дисперсные системы
.pdf
|
|
61 |
|
|
|
Экстраполяция зависимости до оси ординат дает отрезок, рав- |
|||
ный |
1 |
, а тангенс угла наклона равен |
1 |
. |
A K |
|
|||
|
|
A |
||
Экспериментальное определение A позволяет рассчитать площадь, занимаемую одной молекулой ( s0 ), в насыщенном слое на границе раздела фаз
1
s0 , (3.53)
A N A
Толщину адсорбционного слоя или длину молекулы можно рассчитать по уравнению
|
A M |
|
|
|
|
, |
(3.54) |
|
|||
|
|
|
|
где – плотность адсорбата; M – молекулярная масса адсорбата. |
|||
Удельную поверхность адсорбента рассчитывают по уравне- |
|||
нию |
|
|
|
sžŸ A N A s0 , |
(3.55) |
||
где s уд – удельная поверхность адсорбента (поверхность единицы массы адсорбента).
3.5.4. Связь уравнений Гиббса, Ленгмюра и Шишковского. Изотермы адсорбции и поверхностного натяжения растворов ПАВ
Особенностью специфических дифильных молекул ПАВ является большая поверхностная активность по отношению к воде, что характеризует сильную зависимость поверхностного натяжения водного раствора ПАВ от их концентрации. Большие значения поверхностной активности предполагают пренебрежимо малые концентрации ПАВ в объеме раствора по сравнению с их концентрацией в поверхностном слое, т. е. с величиной их адсорбции на границе раствор – воздух. Эта особенность позволяет пренебречь разницей между величиной адсорбции A и величиной гиббсовской адсорбции Г , т. е. Г A. Закон Генри, характеризующий адсорбцию при малых концентрациях, для неиногенных ПАВ имеет вид

62
A ´ K ´ c . |
(3.56) |
В такой записи закон Генри можно сопоставить с адсорбционным уравнением Гиббса
A ´ K ´ c |
c |
|
d |
. |
(3.57) |
|
|
||||
|
RT dc |
|
|||
Разделим переменные и проведем интегрирование уравнения (3.57) в пределах от 0 (поверхностное натяжение чистого растворителя) до (поверхностное натяжение раствора) и соответственно от c 0 до c
|
c |
|
|
d K ´ RTdc . |
(3.58) |
0 |
0 |
|
После интегрирования получим
0 K ´ RTc . |
(3.59) |
Таким образом, в области действия закона Генри поверхностное натяжение линейно уменьшается с увеличением концентрации неионогенного ПАВ (рис.3.8).
A ´ , |
A Г K Г c |
A ´ , |
|
|
|
|
|
||
0 |
|
0 |
|
A Г |
|
|
|
|
|
|
|
|
|
|
|
a |
c |
б |
c |
|
|
|
Рис. 3.8. Изотермы адсорбции и поверхностного натяжения для растворов ПАВ a – в области действия закона Генри; б – в области действия изотермы Ленгмюра.
63
Тангенс угла наклона прямой f c (рис.3.8 а) определяет
поверхностную активность (с обратным знаком), а из уравнений (3.57) – (3.59) следует, что
d |
|
|
||
g |
|
|
RTK ´ . |
(3.60) |
|
||||
|
dc c 0 |
|
|
|
Поверхностная активность ПАВ пропорциональна константе распределения Генри. При увеличении концентрации закон Генри перестает соблюдаться и следует обратиться к уравнению Ленгмюра. Учитывая, что A Г , величину адсорбции можно приравнять к ее выражению, соответствующему уравнению Гиббса
|
A ´ A |
|
Kc |
|
|
|
c |
|
d |
. |
(3.61) |
|||
|
|
|
|
|
|
|
|
|||||||
|
|
|
1 Kc |
RT dc |
|
|||||||||
Разделяем переменные |
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
d A RT |
|
|
dc , |
(3.62) |
|||||||||
|
|
|
|
|||||||||||
интегрируем |
|
|
|
|
|
|
1 Kc |
|
||||||
d A RT c |
|
|
|
|
A RT c d ln 1 Kc , |
|
||||||||
|
|
Kdc |
(3.63) |
|||||||||||
|
|
|
|
|||||||||||
|
|
|
1 Kc |
|
|
|
|
|
||||||
0 |
|
0 |
|
|
0 |
|
|
|
||||||
так как d 1 Kc Kdc . После интегрирования получаем уравнение
Шишковского, характеризующее зависимость поверхностного натяжения растворов ПАВ от концентрации
0 A RT ln 1 Kc . |
(3.64) |
Свое уравнение Шишковский получил опытным путем
0 B ln 1 Kc . |
(3.65) |
Ленгмюр, связав уравнение Гиббса со своим уравнением, определил физический смысл констант эмпирического уравнения Шишковского: B A RT , другая константа K имеет смысл константы адсорб-

64
ционного уравнения в уравнении Ленгмюра (или константы обмена). Допущения, принятые при выводе уравнения Шишковского, показывают, что это уравнение в отличие от уравнений Гиббса и Ленгмюра справедливо только для поверхностно-активных веществ, обладающих высокой поверхностной активностью.
3.5.5. Уравнение Фрейндлиха
Представления, развитые Ленгмюром, в значительной степени идеализируют и упрощают действительную картину адсорбции. На самом деле поверхность большинства адсорбентов неоднородна, между адсорбированными частицами имеет место взаимодействие, в этом случае уравнение изотермы усложняется. Фрейндлих предположил, что масса адсорбированного газа или растворенного вещества, приходящаяся на единицу массы адсорбента, должна быть пропорциональна равновесному давлению газа или равновесной концентрации, возведенной в какую-то дробную степень. Другими словами, чем выше давление и чем больше концентрация растворенного вещества, тем больше вещества будет адсорбироваться на поверхности, однако пропорциональность должна носить степенной характер
A K p1/ n |
(3.66) |
или |
|
A Kc1/ n , |
(3.67) |
где A – удельная адсорбция; К, n – постоянные для данной адсорбционной системы; с – равновесная концентрация; p – давление газа. Константа K зависит от природы адсорбента и изменяется в широ-
ких пределах. Величина 1 характеризует степень приближения n
изотермы к прямой линии. Вид изотермы адсорбции совпадает с
изотермой Ленгмюра (рис. 3.6). В области малых концентраций 1 = n
1 и уравнение (3.67) принимает вид: A K c .

65
Адсорбция прямо пропорциональна концентрации (участок
кривой ab). В области больших концентраций 1 = 0 и A A , ад-
n |
|
|
сорбция имеет максимальное значение (участок кривой сd). В об-
ласти средних концентраций 0 < 1 < 1, наблюдается нелинейная за- n
висимость A = f(c) (участок кривой bс). Уравнение Фрейндлиха хорошо работает в области средних концентраций. Для нахождения коэффициентов в уравнении Фрейндлиха уравнение (3.67) лога-
рифмируют: |
|
||
ln A ln K |
1 |
ln c . |
(3.68) |
|
|||
|
n |
|
|
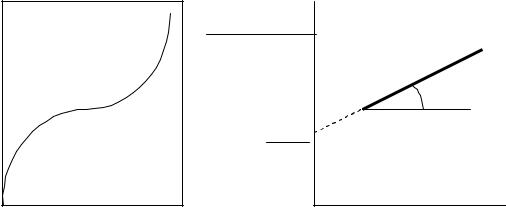
Затем по экспериментальным данным строят график зависимости ln A f (lnc ) (рис. 3.8).
Экстраполяция зависимости на ось ординат дает отрезок, рав-
ный ln K , а тангенс угла наклона прямой к оси абсцисс равен 1 . n
Определив параметры уравнения изотермы адсорбции, можно рассчитать величину адсорбции в области средних концентраций.
ln A
ln K tg 1 n
ln c
Рис. 3.8. Изотерма адсорбции в координатах линейной формы уравнения Фрейндлиха
3.5.6. Теория полимолекулярной адсорбции
В большинстве случаев мономолекулярный слой не компенсирует полностью избыточную поверхностную энергию, и влияние поверхностных сил может распространяться на второй, третий и последующие адсорбционные слои. Эта возможность реализуется, ко-

66
гда газы и пары адсорбируются при температурах ниже критической (когда возможна конденсация). В этом случае образуются полимолекулярные слои на поверхности адсорбента.
Полимолекулярную адсорбцию можно представить как результат вынужденной конденсации пара под действием поверхностных сил. Если в области образования монослоя величина адсорбции существенно замедляет свой рост с увеличением давления пара, то в области давления, близкого к давлению насыщенного пара ( Ps ), она резко начинает возрастать и заканчивается объемной конденсацией пара при P Ps .
Теория полимолекулярной адсорбции была разработана в 1935 – 1940 г. Брунадэром, Эмметом и Теллером и получила название БЭТ (по первым буквам фамилий авторов). В этой теории дополнительными положениями к тем, что были положены в основу теории Ленгмюра, являются:
1)каждая молекула предыдущего слоя представляет собой возможный активный центр для адсорбции следующего адсорбционного слоя;
2)возможно построение последующих слоев при незавершенных предыдущих слоях;
3)взаимодействие соседних адсорбированных молекул в первом и последнем слое отсутствуют;
4)все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости. Адсорбированная фаза может быть представлена совокупностью адсорбционных комплексов молекул, первая из которых связана с поверхностью адсорбента (рис. 3.9).
Первый слой адсорбата образуется в результате действия ван- дер-ваальсовых сил между адсорбентом и адсорбатом, последующие – в результате конденсации наиболее šхолодныхŸ молекул пара.
Рис. 3.9. Схема построения адсорбционного слоя
Процесс адсорбции может быть представлен в виде последовательных квазихимических реакций образования единичных и кратных адсорбционных комплексов.

67
Введем обозначения: A – активный адсорбционный центр; B – адсорбируемое вещество; AB – комплекс, образующийся на поверхности:
A B AB – первый слой;
AB B AB2 – второй слой;
AB2 B AB3 – третий слой и т. д.
В теории БЭТ было получено уравнение полимолекулярной
адсорбции |
|
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
A |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
A |
|
|
|
|
|
ps |
|
, |
(3.69) |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||
|
1 |
p |
1 (C 1) |
p |
|
|
|||||
|
p |
|
|||||||||
|
|
p |
|
|
|
|
|
|
|
||
|
|
|
s |
|
|
|
s |
|
|||
где A – величина адсорбции; A – емкость одного адсорбционного |
|||||||||||
монослоя; p – данное равновесное давление пара; |
ps – давление |
||||||||||
насыщенного пара (относительно второго, третьего и т. д. слоев);
p
– относительное давление; C - постоянная, равна отношению
ps
констант равновесия адсорбции (мономолекулярной) и конденсации
|
K p |
|
|
a |
1 |
|
|
пара C |
|
, KL |
|
 |
|
|
. |
KL |
aà |
|
|||||
|
|
|
|
ps |
|||
Зависимость |
A f p / ps приведена на рис. 3.10 а. Соотно- |
||||||
шение (3.69) называется уравнением полимолекулярной адсорбции БЭТ. Это уравнение является наиболее общим уравнением адсорб-
ции, так как с уменьшением давления при P <<1 уравнение БЭТ
Ps
превращается в уравнение мономолекулярной адсорбции Ленгмюра, которое при дальнейшем уменьшении давления ( P 0) переходит в уравнение Генри. Уравнение (3.69) применяется с хорошим приближением в области относительных давлений 0,5 p / ps 0,3 . При обработке экспериментальных результатов уравнение (3.69) используют в линейной форме
p / ps |
|
1 |
|
C 1 |
|
p |
. |
(3.70) |
A 1 p / ps |
A C |
|
|
|||||
|
|
A C ps |
|
|||||
|
|
68 |
|
|
A |
a |
p / p |
s |
б |
|
|
|
||
|
|
A 1 p / ps |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
A C |
|
|
0 |
p / ps |
1 |
|
p / p s |
|
|
|
|
|
Рис. 3.10. a – изотерма полимолекулярной адсорбции; б
– изотерма полимолекулярной адсорбции в координатах линейной формы уравнения БЭТ.
Уравнение (3.70) позволяет графически определить параметры A и
C . Отрезок, отсекаемый на оси ординат, равен |
1 |
, а tg |
C 1 |
|
|
|
A C A C
(рис. 3.10 б).
3.5.7. Энергетические параметры адсорбции на однородной поверхности
Основными энергетическими параметрами адсорбции являются энергия Гиббса, энтальпия и энтропия. Эти параметры связаны уравнением
∆G = ∆H - T∆S. |
(3.71) |
Адсорбция является самопроизвольным процессом, поэтому сопровождается уменьшением энергии Гиббса. Самопроизвольному процессу при p,Т = const отвечает условие ∆G < 0.
При адсорбции уменьшается и энтропия (∆S < 0), т. к. свобода движения молекул на поверхности адсорбента ограничена.
Из уравнения (3.71) следует, что энтальпия должна также уменьшаться, т. е. ∆H < 0. Адсорбция газов и паров, как правило, процесс экзотермический.
Если адсорбция подчиняется уравнениям Генри и Ленгмюра (константа адсорбции не зависит от степени заполнения поверхно-
69
сти адсорбента), то стандартная энергия Гиббса определяется по уравнению изотермы Вант-Гоффа
G0 RT ln K . |
(3.72) |
Если K является константой Генри, то G0 характеризует переход адсорбата из стандартного состояния в объеме в стандартное состояние его на поверхности. Если K является константой равнове-
сия в уравнении Ленгмюра, то G0 определяет химическое сродство между адсорбатом и адсорбционными центрами поверхности адсорбента.
Стандартную энтальпию определяют из экспериментальной зависимости константы равновесия адсорбции от температуры по уравнению изобары Вант – Гоффа при постоянном давлении
d ln K |
H |
0 |
|
|
|
|
|
|
|
, |
(3.73) |
|
|
|
|||
dT |
RT 2 |
|
|||
где H 0 =∆Hадс - ∆Hv; ∆Hадс – энтальпия адсорбата на адсорбенте; ∆Hv – энтальпия адсорбата в объеме (или химической реакции).
Интегрируем уравнение изобары, считая, что H 0 практически не зависит от температуры. При этом получается уравнение линейной зависимости
ln K |
H |
0 |
const , |
(3.74) |
|
|
RT
в координатах lnK – 1/Т. Тангенс угла наклона прямой равен
|
H 0 |
, отсюда |
H 0 Rtg . |
|
R
Стандартную энтропию адсорбции, подчиняющуюся уравнению Ленгмюра (Генри), с учетом уравнений (3.72) и (3.74), рассчитывают по уравнению
S 0 |
H 0 G0 |
|
H 0 RT ln K |
. |
(3.75) |
|
|
T T

70
Все эти уравнения для расчета энергетических параметров адсорбции получены, исходя из предположения, что поверхность адсорбента однородна, и на ней образуется мономолекулярный слой адсорбата, а энергетические параметры адсорбции не зависят от степени заполнения поверхности.
Если адсорбция происходит на неоднородной поверхности, то наиболее реакционно-способные активные центры будут заняты уже при малых равновесных концентрациях. В этом случае энергетические параметры зависят от степени заполнения поверхности адсорбента адсорбатом.
3.5.8. Теплота адсорбции
По величине теплоты адсорбции можно судить о природе происходящих процессов, определить физическая или химическая адсорбция, оценить активность поверхности адсорбента.
Характерной чертой физической адсорбции является уменьшение величины теплоты адсорбции при увеличении степени заполнения поверхности адсорбента. На неоднородной поверхности сначала заполняются более активные центры. Адсорбция на них протекает быстро. Затем заполняются менее активные центры, в результате чего теплота адсорбции уменьшается.
В зависимости от условий определения теплоты адсорбции существуют разные способы ее выражения.
Интегральная теплота адсорбции qÆ , выраженная в единицах
Дж
, представляет собой количество тепла, выделившегося
гадсорбента
при адсорбции Na молекул газа или пара на чистой поверхности 1 г адсорбента, и определяется выражением
|
(3.76) |
qu Na E´ Ea , |
где E´ – энергия газа в газовой фазе, приходящаяся на одну молекулу; Ea – энергия газа в адсорбированном состоянии, приходящаяся на одну молекулу; Na – число адсорбированных молекул газа или пара.
