
Поверхностные явления и дисперсные системы
.pdf
51
Исследуя поверхностное натяжение водных растворов ПАВ, Дюкло и Траубе установили зависимость между поверхностной активностью и числом углеродных атомов для низших членов гомологического ряда жирных кислот. Эта важная зависимость получила название правила Дюкло – Траубе:
При увеличении числа углеродных атомов (п) в гомологическом ряду в арифметической прогрессии поверхностная активность
(g) возрастает в геометрической прогрессии, причем увеличение углеводородной части молекулы на одну группу СН2 соответствует возрастанию поверхностной активности в 3-3,5 раза
gn 1 |
3,0À3,5. |
(3.30) |
|
gn |
|||
|
|
Причина такой зависимости заключается в том, что с увеличением длины углеводородной цепи уменьшается растворимость жирной кислоты и тем самым увеличивается стремление ее молекул перейти из объема в поверхностный слой (рис.3.4)
ГАЗ |
|
Г |
|
0 |
Г |
|
|
|
|
|
1 |
|
|
2 |
|
ЖИДКОСТЬ |
|
|
|
c |
2 |
1 |
c |
Рис. 3.4. Зависимость поверхностного натяжения и гиббсовской адсорбции от концентрации для 1 – муравьиной и 2 – пропионовой кислот.
Шишковский Б.А. опытным путем вывел зависимость поверхностного натяжения от концентрации жирных кислот в водных растворах:
0 B ln 1 Ac . |
(3.31) |
При подстановке этого уравнения в уравнение Гиббса (3.26)
|
|
|
|
52 |
|
|
|
|
c |
|
d |
B ln 1 Ac |
|
|
|
´ |
|
|
0 |
|
, |
(3.32) |
|
RT |
|
|
|
dc |
|||
|
|
|
|
|
|
||
получаем выражение
Г |
c |
B |
1 |
A. |
(3.33) |
|
1 Ac |
||||
|
RT |
|
|
||
При высоких концентрациях ´ ´ , адсорбция равна предельной адсорбции ПАВ, единицей пренебрегаем, получаем
´ |
|
|
B |
, иначе B ´ RT . |
(3.34) |
|
|||||
|
|
RT |
|
|
|
|
|
|
|
|
При высоких концентрациях константа B имеет одно и то же значение для одного гомологического ряда. Это значит, что независимо от длины цепи в гомологическом ряду каждая молекула занимает одну и ту же площадь в поверхностном слое. Так для различных жирных кислот эта величина равна
s |
1 |
2,1 ½ ¾ 2 . |
|
||
0 |
´ N A |
|
|
|
Константа A уравнения Шишковского характеризует поверхностную активность ПАВ и возрастает при переходе от Cn Cn 1 одного гомологического ряда (например, от пропионовой C2 H5COOH к масляной C3H7COOH кислоте) в 3 – 3,5 раза. Это находится в соответствии с правилом Дюкло – Траубе.
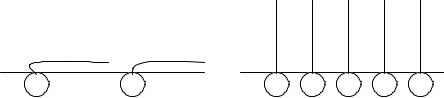
Строение и свойства адсорбционных слоев. При малой концентрации адсорбированных молекул в поверхностном слое тепловое движение нарушает их ориентацию, и молекулы в основном расположены в поверхностном слое горизонтально и как бы плавают на поверхности воды, при этом полярные группы остаются в воде, углеводородные цепи лежат на поверхности (псевдогазовые пленки) (рис. 3.5).
При повышении концентрации ПАВ усиливается взаимодействие углеводородных цепей между собой. Их углеводородные радикалы отрываются от поверхности воды и нормально ориентируются к ней, и при насыщении адсорбционного слоя создается возмож-
53
ность образования šмолекулярного частокола ЛенгмюраŸ из вертикально расположенных молекул. В этом состоянии площадь,
a |
воздух |
б |
вода
Рис. 3.5. Расположение молекул ПАВ на границе вода – воздух: a – при малых концентрациях; б – в насыщенном растворе (мономолекулярный слой šчастокол ЛенгмюраŸ).
занимаемая молекулой, определяется лишь площадью полярной группы, постоянной для всех членов гомологического ряда, что и объясняет постоянство константы B в уравнении Шишковского. Длина углеводородных цепей и их энергия взаимодействия изменяются при каждом удлинении цепи на группу CH2 . Это объясняет изменение второй константы A в уравнении Шишковского
3.5. Адсорбция на границе газ – твердое тело
Адсорбция протекает вследствие стремления к минимуму поверхностной энергии или энергии Гиббса всей системы. Это самопроизвольный процесс, при котором происходит выравнивание химических потенциалов веществ в объеме системы и в межфазном (поверхностном) слое.
Предполагается, что на поверхности твердого тела присутствуют активные адсорбционные центры, и молекулы адсорбата взаимодействуют с этими активными центрами. Если отсутствует химическое взаимодействие адсорбата с адсорбентом, то адсорбция, как правило, является результатом самопроизвольного уменьшения поверхностной энергии системы, выражающееся в компенсировании поля поверхностных сил. При наличии специфического сродства адсорбата к адсорбенту, адсорбция обусловлена самопроизвольным уменьшением энергии Гиббса всей системы, что может привести даже к увеличению поверхностной энергии.
54
При химической адсорбции между адсорбатом и адсорбентом образуется химическая связь, и они теряют индивидуальность. Если осуществляется химическая адсорбция (хемосорбция), то происходит химическое присоединение атомов (молекул) или ионный обмен. При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей. Эти адсорбционные силы обеспечивают притяжение атомов (молекул); на очень близком расстоянии проявляются короткодействующие силы отталкивания.
3.5.1. Закон Генри
Поверхность твердых тел, как правило, неоднородна геометрически (шероховатость, наличие дефектов) и химически, и чтобы получить простейшие закономерности адсорбции, необходимо предположить, что поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое. Если поверхностный слой представить как отдельную фазу, то можно рассматривать процесс перераспределения вещества как выравнивание химических потенциалов распределяемого вещества в адсорбционном слое и в объеме . При равновесии . Используем уравнения
|
|
|
0 RT ln |
a |
и |
0 RT ln a . |
(3.35) |
При равновесии
|
0 RT ln |
a |
RT ln a , |
(3.36) |
где a , a – активности распределяемого вещества в адсорбционном слое и в объеме соответственно.
Выражаем из уравнения (3.36) отношение активностей
|
|
|
|
|
|
0 |
|
0 |
|
|
a |
|
|
|
|||||||
|
exp |
|
|
K´ , |
(3.37) |
|||||
a |
|
|
|
RT |
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
55
где K ´ – константа распределения, называемая константой Генри, она не зависит от концентрации. Так как a c , а величина концентрации распределяемого вещества в адсорбционном слое равна величине адсорбции, т. е. c A. Для неэлектролитов (в том числе для газов и паров) получаем a A , подставляем в (3.37)
A |
|
K ´ , |
A K ´ |
c |
|
или D |
A |
K ´ |
|
|
|
, |
(3.38) |
|
c |
|
|
|
|
|
|
|
|
||||||
|
|
|
||||||||||||
|
|
|
|
c |
|
|
||||||||
где A – величина адсорбции – концентрация адсорбата или количество вещества в адсорбционном слое, приходящееся на единицу поверхности (на единицу массы адсорбента); D – коэффициент распределения. Уравнение (3.38) отражает изотерму адсорбции в общем виде при любых концентрациях. Но коэффициенты активности и величина адсорбции зависят от концентрации, а вид зависимости чаще всего неизвестен. Так как для бесконечно разбавленных растворов (при малом давлении газа) коэффициенты активности равны единице, то на основании уравнения (3.38) можно сформулировать следующую закономерность:
при разбавлении системы (уменьшении давления) коэффициент распределения стремится к постоянному значению, равному константе распределения Генри.
Относительно величины адсорбции этот закон имеет вид
A K ´ c, |
|
(3.39) |
A K ´ p , |
где p – давление газа или пара, которое связано с концентрацией согласно уравнение Менделеева – Клапейрона для идеального газа p cRT , т. е. K ´ K ´ RT .
Уравнения (3.39) представляют собой изотермы адсорбции вещества при малых концентрациях. Соответственно формулировка закона Генри:
величина адсорбции при малых давлениях газа (концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации). При повышении концентрации линейная зависимость нарушается.
56
3.5.2. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
Чтобы получить теоретическую изотерму адсорбции, описывающую более широкую область концентраций, необходимо использование представлений о механизме адсорбции и конкретных моделей. Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра. Основной вывод теории: по мере увеличения концентрации происходит адсорбционное насыщение поверхности адсорбента. Этот вывод уточняется следующими положениями:
1.Адсорбция молекул адсорбата происходит на активных центрах, всегда существующих на поверхности твердого адсорбента. Такими центами являются пики, возвышения на поверхности, ребра, углы кристаллов и границы зерен в микронеоднородном сорбенте. Адсорбционные центры энергетически эквивалентны, поверхность адсорбента эквипотенциальна.
2.Каждый активный центр обладает малым радиусом действия
испособен насыщаться. Поэтому активный центр может взаимодействовать лишь с одной молекулой адсорбата. Адсорбция, таким образом, локализована на отдельных адсорбционных центрах. В результате адсорбции на поверхности адсорбента может образоваться только один (мономолекулярный) слой адсорбата. Такая адсорбция называется мономолекулярной.
3.Адсорбционные молекулы удерживаются данным активным центром только в течение определенного промежутка времени, десорбируясь, они уходят в газовую фазу. Взамен этих молекул активные центры могут адсорбировать новые молекулы. Время пребывания молекул в адсорбированном состоянии сильно зависит от температуры: при низких температурах время может быть сколь угодно большим, при температурах порядка 1000-2000¾С время пребывания молекул в адсорбированном состоянии может равняться миллионным долям секунды.
4.Адсорбционные молекулы не взаимодействуют друг с другом. Поэтому время пребывания молекул на активных центрах не зависит от того, заняты молекулами соседние активные центры или нет.
На основании этих положений было выведено уравнение изотермы локализованной адсорбции, пригодное для описания адсорб-

57
ции, как газов, так и растворенных веществ. Примем, что при адсорбции происходит квазихимическая реакция между распределяемым компонентом и адсорбционными центрами поверхности
|
|
|
|
|
|
|
A |
B AB , |
(3.40) |
||
где A – адсорбционные центры поверхности; B – распределяемое вещество; AB – комплекс, образующийся на поверхности.
По мере увеличения концентрации (давления) вещества B реакция сдвигается в сторону образования комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия K (без учета коэффициентов активности реаги-
рующих веществ) равна |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
K |
c |
|
|
|
. |
|
|||
|
|
|
AB |
(3.41) |
||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
c |
|
cB |
|
|
||
В этом соотношении |
A |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||
c |
|
A , |
c |
|
A0 |
A A, |
(3.42) |
|||||
AB |
A |
|||||||||||
где A – величина адсорбции; A – емкость адсорбционного монослоя (число адсорбционных центров, приходящихся на единицу площади поверхности или единицу массы адсорбента); A0 – число оставшихся свободными адсорбционных центров, приходящихся на единицу площади поверхности или единицу массы адсорбента, cB c – концентрация распределяемого вещества.
Подставляя уравнение (3.42) в уравнение (3.41), получаем
K |
|
|
A |
, |
(3.43) |
|
A |
A c |
|||||
|
|
|
|
|
|
|
отсюда |
Kc |
|
|
|
||
A A |
|
. |
|
(3.44) |
||
|
|
|
||||
|
1 Kc |
|
|
|||
Выражение (3.44) называется уравнением изотермы мономолекулярной адсорбции Ленгмюра.

58
Так как концентрации газов и паров практически пропорциональны давлениям, то для них изотерма адсорбции Ленгмюра принимает вид
A A |
K p p |
, |
(3.45) |
1 K p p |
|||
где K p – константа адсорбционного равновесия; |
p – давление газа |
||
или пара.
Константа адсорбционного равновесия в уравнении Ленгмюра ( K или K p ) характеризует энергию взаимодействия адсорбата с ад-
сорбентом (химическое сродство G0 RT ln k ). Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
3.5.3. Анализ и применение уравнения изотермы адсорбции Ленгмюра
Уравнение Ленгмюра применимо не только для адсорбции газов и паров твердыми адсорбентами, но и для адсорбции на границах жидкость – газ и жидкость – твердое тело.
Величина A зависит от числа адсорбционных центов на единице поверхности или массы адсорбента и размеров молекул адсорбата. Чем крупнее молекула адсорбата, тем больше площадь, занимаемая молекулой в адсорбционном слое и тем меньше A . Величина A – предельная адсорбция – выражается числом молей ад-
сорбата на единицу площади ( моль ) или единицу массы адсорбента м2
( моль ). Константы K и A называют постоянными параметрами кг
адсорбционной системы. Адсорбционное уравнение Ленгмюра часто представляют относительно степени заполнения поверхности – отношение величины адсорбции A к емкости монослоя A (степень заполнения )
|
A |
|
Kc |
|
c |
, |
(3.46) |
|
|
K c |
|||||
|
A |
1 Kc |
|
|
|||
где K 1/ K .
59
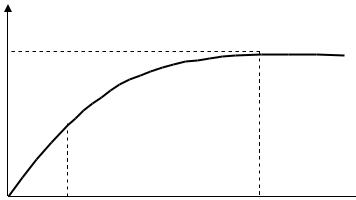
Типичная изотерма адсорбции Ленгмюра показана на рис.3.6.
A |
d |
c |
|
A |
|
b |
|
a
c p
Рис. 3.6. Изотерма адсорбции Ленгмюра
Важны экстраполяционные следствия соотношений (3.44) – (3.46). При малых концентрациях или давлениях, когда с 0, получаем:
A A K c ; |
(3.47) |
A A K p p , |
(3.48) |
Kc . |
(3.49) |
Выражения (3.47) – (3.49) соответствуют |
закону Генри |
A K K ´ : величина адсорбции линейно растет с увеличением
концентрации (давления) (участок кривой ab ). Таким образом, уравнение Ленгмюра является общим соотношением, включающим и уравнение Генри.
При больших концентрациях и давлениях, когда |
K c >>1 и |
K p P >>1, уравнения (3.44) – (3.46) переходят в соотношение: |
|
A A и 1. |
(3.50) |
Соотношение (3.50) отвечает насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата (участок кривой сd).
При средних концентрациях и давлениях используются уравнения (3.44) и (3.45) (участок bc ). В этой области концентраций и
60
давлений уравнениям Ленгмюра можно придать форму, когда концентрация или давление входит в дробной степени, например
A A c1/ n . |
(3.51) |
Это уравнение сходно с уравнением Фрейндлиха и отвечает параболическому участку изотермы адсорбции Ленгмюра (участок bc).
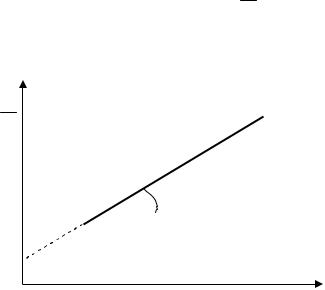
Экспериментальные результаты по адсорбции обычно обрабатывают с помощью уравнения Ленгмюра, записанного в линейной форме. Поменяем местами числитель и знаменатель в уравнении (3.44):
1 |
|
1 K c |
; преобразуем |
1 |
|
1 |
|
1 |
. |
|
|
|
|
|
|||||
A A K c |
A A Kc |
|
A |
||||||
Умножим правую и левую части уравнения на с
c |
|
1 |
|
1 |
c . |
(3.52) |
|
|
|
AA K A
Полученная линейная зависимость c f ( c ) позволяет опре-
A
делить обе постоянные K и A адсорбционной изотермы (рис. 3.7).
c
A
|
|
|
||
1 |
|
tg |
1 |
|
A K |
A |
|||
|
||||
c
Рис.3.7. Изотерма адсорбции в координатах линейной формы уравнения Ленгмюра
