
Поверхностные явления и дисперсные системы
.pdf91
осаждающимися в жидкости частицами установить электроды на разной высоте, то между ними можно измерить разность потенциалов – потенциал седиментации.
4.3. Строение двойного электрического слоя
Общими для всех теорий строения ДЭС являются следующие положения:
-ДЭС состоит из потенциалопределяющих ионов, прочно связанных с дисперсной фазой, и эквивалентного количества противоионов, расположенных в жидкой дисперсионной среде;
-поверхностный заряд, обусловленный наличием на твердой поверхности потенциалопределяющих ионов, равномерно распределен по всей твердой поверхности дисперсной фазы;
-между противоионами ДЭС и ионами раствора такого же знака существует динамическое равновесие;
-жидкая дисперсионная среда влияет на строение ДЭС через величину диэлектрической проницаемости.
Отличие предложенных теорий заключается в том, что их авторы давали различное толкование структуры слоя противоионов,
т.е. строению внешней обкладки ДЭС, обусловленной расположением противоионов.
Современная теория строения ДЭС основана на представлениях Штерна. Эта теория объединяет две предшествующие теории Гельмгольца-Перрена и Гуи-Чепмена (названные теории здесь не обсуждаются). Изображение ДЭС согласно теории Штерна приведено на рис. 4.4, на котором твердая фаза заряжена положительно, справа от твердой фазы – раствор, содержащий отрицательные противоионы.
Согласно современной теории слой противоионов состоит из двух частей. Одна часть примыкает непосредственно к межфазной поверхности и образует адсорбционной слой (слой Гельмгольца или плотный слой) толщиной , толщина адсорбционного слоя равна радиусу гидратированных ионов, его составляющих. Другая часть противоионов находится в диффузной части – диффузный слой
(слой Гуи) с потенциалом , толщина диффузного слоя может быть значительной и зависит от свойств и состава системы.
Наличие диффузного слоя объясняется тепловым движением

92
|
|
|
– |
A |
|
|
|
+ |
|
|
0 |
|
+ |
– |
|
|
+ |
|
+–
0 |
+ |
– |
|
|
|||
+ |
– |
||
|
+ |
– |
|
|
+ |
||
– |
|||
|
+ |
+ |
– |
|
– |
+ – |
B |
– |
|
+ |
– |
|
|
|
x |
||
|
|
|
|
|
|
|
Рис. 4.4. Двойной электрический обменный слой по Штерну и падение в нем потенциала
противоионов и их взаимным отталкиванием. Полное падение общего поверхностного потенциала o с увеличением расстояния x от поверхности слагается из падения потенциала в слое Гельмгольца ( o ) почти линейного до потенциала диффузного слоя и затем падения потенциала в слое Гуи ( ) по экспоненте.
При относительном перемещении фаз, независимо от причин его вызвавших, происходит разрыв ДЭС по границе скольжения (плоскости скольжения). Предполагается, что плоскость скольжения AB проходит либо на расстоянии , либо смещена глубже в жидкую фазу.
Потенциал, возникающий на границе скольжения, называется
электрическим потенциалом или (дзета ) - потенциалом.
Во многих случаях можно принять, что поскольку теоретические закономерности, предсказанные для потенциала , хорошо подтверждаются на опыте в отношении - потенциала.
Электрокинетический потенциал является важнейшей характеристикой высокодисперсной системы, определяется экспериментально из электрокинетических явлений и обычно составляет единицы и десятки милливольт.

93
4.4. Факторы, влияющие на ДЭС и величину - потенциала
Поскольку - потенциал во многих случаях является величиной, характеризующей устойчивость коллоидной системы, важно рассмотреть влияние различных факторов на его величину. В общем случае - потенциал всегда меньше потенциала диффузного слоя и это различие тем больше, чем меньше протяженность диффузной части ДЭС. Таким образом, все факторы, влияющие на потенциал диффузного слоя, т. е. на величину ДЭС, изменяют значение - потенциала.
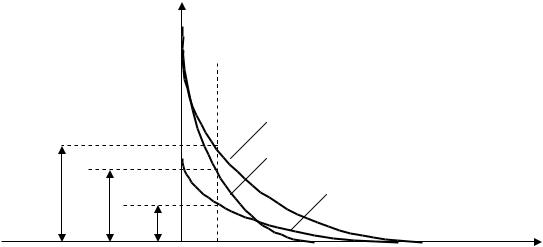
Рассмотрим влияние индифферентного электролита на величину - потенциала. Индифферентный электролит не имеет ионов, способных достраивать кристаллическую решетку коллоидной частицы. С повышением концентрации индифферентного электролита вследствие того, что для компенсации потенциалопределяющих ионов требуется эквивалентное число зарядов противоионов, толщина диффузного слоя уменьшается, так как часть противоионов из диффузного слоя переходит в адсорбционный слой и двойной электрический слой сжимается (рис. 4.5).
A
0
3
2
1
1 2
B |
x |
Рис. 4.5. Влияние индифферентного электролита на толщину ДЭС и величину - потенциала (количество электролита увеличивается от кривой 1 к кривой 3).
Чем больше концентрация электролита, тем больше сжимается ДЭС, тем меньше становится величина - потенциала, определяемого на плоскости скольжения АВ. При достаточно больших кон-
94
центрациях электролита диффузный слой может сжаться до монослоя, толщина ДЭС может стать равной толщине адсорбционного слоя и - потенциал может стать равным нулю. Это соответствует
изоэлектрическому состоянию системы (точка B ). При разбавлении ДЭС расширяется и - потенциал возрастает.
Рассмотрим влияние неиндифферентного электролита на величину - потенциала. Неиндифферентный электролит имеет ион, способный достраивать кристаллическую решетку дисперсной фазы. Потенциалопределяющие ионы этого электролита могут повышать потенциал o за счет дополнительной адсорбции потенциалопределяющих ионов на поверхности, а находящиеся с ним в паре ионы, имеющие одинаковый заряд с противоионами, способны сжимать ДЭС (рис. 4.6).
0 2,3
|
|
A |
|
|
2 |
|
0 1 |
3 |
2 |
3 |
1 |
|
1 |
|
|
B |
x |
Рис. 4.6. Влияние неиндифферентного электролита на величину - потенциала (количество электролита увеличивается от кривой 1 к кривой 3)
При малых концентрациях неиндифферентного электролита проявляется первая тенденция – возрастает потенциал o , при этом возрастает - потенциал. При больших концентрациях неиндифферентного электролита, когда достройка кристаллической решетки завершена, превалирует вторая тенденция – сжатие ДЭС. При этомпотенциал уменьшается. Поэтому при введении в систему все возрастающих количеств неиндифферентного электролита - потенциал сначала возрастает, а потом падает.
95
Аналогично концентрации на - потенциал действует и температура. С повышением температуры - потенциал может возрастать, вследствие возрастания интенсивности теплового движения противоионов и увеличения толщины двойного электрического слоя. Однако одновременно с этим может возрастать и десорбция потенциалопределяющих ионов, что ведет к уменьшению значенийo - и - потенциалов.
На величину - потенциала оказывает влияние рН среды, концентрация коллоидной системы, природа дисперсионной среды.
4.5. Строение коллоидных мицелл
Мицелла – это сложное структурное образования, состоящее из агрегата, потенциалопределяющих ионов и противоионов. Рассмотрим строение мицеллы на примере йодида серебра, образованного методом химической конденсации при небольшом избытке йодида калия:
AgNO3 + KI AgI + KNO3.
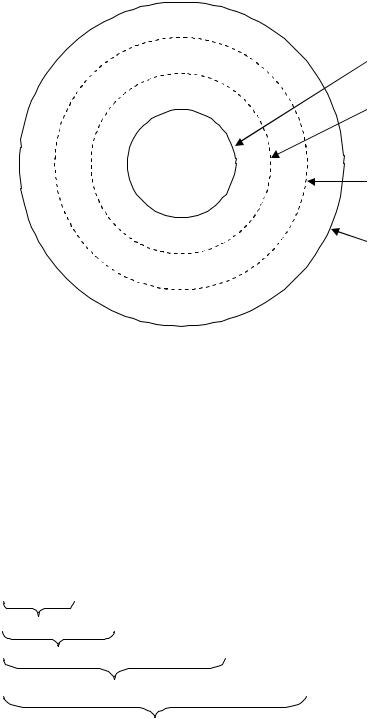
В этом случае образование ДЭС происходит за счет специфической адсорбции. Внутреннюю часть мицеллы составляет агрегат основного малорастворимого вещества AgI. Агрегат состоит из атомов, молекул и ионов, определяющих дисперсную фазу. Агрегат электронейтрален и обладает большой адсорбционной способностью, агрегат способен адсорбировать на своей поверхности ионы из раствора, которые называются потенциалопределяющими ионами. На рис. 4.7 представлена схема строения мицеллы золя йодида серебра в растворе йодида калия. Потенциалопределяющими ионами являются ионы I , так как они способны достраивать решетку йодида серебра.
Агрегат вместе с адсорбированными на нем потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее в приведенном примере большим отрицательным зарядом, притягивает ионы противоположного заряда (противоионы) из раствора (катионы К+). Часть противоионов, которая находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электрических сил, образует адсорбционный слой (слой Гельмгольца).
96
|
|
|
|
K |
|
|
|
|
|
|
+ |
|
|
K |
|
|
+ |
агрегат |
|
|
+ |
|
– |
I |
|
– |
|
+ |
ядро |
|
– |
|
– |
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
+ |
|
– |
|
m AgI |
|
|
– |
+ |
|
+ – |
|
|
|
|
– |
+ |
частица |
||
|
|
|
|
– |
|
||||
|
– |
|
– |
|
|
||||
|
|
|
|
|
|
мицелла |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
+ |
+ |
+ |
|
||
|
|
Рис. 4.7. Схема строения мицеллы золя
Ядро с противоионами адсорбциионного слоя образует гранулу или коллоидную частицу. В отличие от мицеллы, частица всегда имеет заряд. Знак заряда коллоидной частицы определяется знаком потенциалопределяющих ионов (на рис. 4.7 частица заряжена отрицательно).
Коллоидную частицу (гранулу) окружают противоионы диф-
m[ AgI ] nI ( n x )K x xK
агрегат
ядро
частица
мицелла
фузного слоя, т. е. остальная часть противоионов, которая подвергается броуновскому движению и менее прочно связанна с ядром. Частица вместе с противоионами диффузного слоя образует мицеллу. Мицелла в отличие от частицы электронейтральна. Мицеллу можно представить формулой
m – количество молекул или атомов, образующих агрегат; n – число потенциалопределяющих ионов; n x - число противоионов в
97
адсорбционном слое ДЭС; x – число противоионов в диффузной части ДЭС.
Под действием внешнего электрического поля мицелла разрывается по границе скольжения, находящейся в диффузном слое ДЭС. Заряженная коллоидная частица перемещается к одному электроду, а ионы диффузного слоя (часть противоионов) движутся вместе с жидкостью к другому электроду.
Электролит, ионы которого образуют двойной электрический слой, называют стабилизатором, так как он стабилизирует золь, т. е. придает ему агрегативную устойчивость. В нашем примере это
КI.
Рассмотрим еще один пример. При погружении частиц двуокиси кремния SiO2 в воду, происходит образование ДЭС за счет ионизации молекул на поверхности частиц двуокиси кремния. Молекулы двуокиси кремния, находящиеся на поверхности частиц, взаимодействуют с дисперсионной средой, гидратируются и образуют кремниевую кислоту, способную ионизироваться
SiO2 H2O H2SiO3 2H SiO32 .
При этом силикатные ионы SiO32 остаются на поверхности частицы, обуславливая ее заряд, а ионы водорода переходят в раствор. Формула мицеллы золя двуокиси кремния, когда стабилизатором является кремниевая кислота, имеет вид
2x
m SiO2 nSiO32 2 n x H 2xH
Агрегат основного вещества m SiO2 , потенциалопределяющие ио-
ны SiO32 , противоионы H . Агрегат с потенциалопределяющими ионами образуют ядро, ядро с частью противоионов образуют частицу (в фигурных скобках). Частица вместе с противоионами диффузного слоя образует мицеллу. Знак коллоидной частицы отрицательный, количество противоионов в два раза больше, чем потенциалопределяющих ионов из-за разности в их валентности.
98
ГЛАВА 5. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ
5.1. Основные понятия и определения
Проблема устойчивости дисперсных систем является одной из важнейших в коллоидной химии. Обеспечение устойчивости свободнодисперсных систем необходимо при получении из них различных изделий, покрытий, связующих материалов, лекарственных препаратов, аэрозольных средств и т. д. Ликвидация устойчивости требуется для того, чтобы вызвать структурообразование в материалах, для получения осадков при разделении фаз, очистки промышленных выбросов и др.
Под устойчивостью дисперсных систем понимают постоянство их свойств во времени и в первую очередь дисперсности, распределения по объему частиц дисперсной фазы и межчастичного взаимодействия, т. е. устойчивость к укрупнению или агрегации частиц дисперсной фазы и к их осаждению. Процессы агрегации и осаждения характерны для свободнодисперсных систем.
По предположению Н.П. Пескова устойчивость дисперсных систем подразделяют на два вида: седиментационная (кинетическая) устойчивость и агрегативная устойчивость.
Седиментационная устойчивость (устойчивость к осаждению) характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды, или устойчивость к разделению фаз.
При нарушении седиментационной устойчивости (что характерно для грубодисперсных систем) происходит разделение фаз, и частицы дисперсной фазы оседают (или всплывают).
Агрегативная устойчивость характеризует способность частиц дисперсной фазы оказать сопротивление их слипанию (коагуляции) и тем самым удерживать определенную степень дисперсности в целом.
Коагуляция (от лат. свертывание, затвердение) – процесс слипания частиц, образования более крупных агрегатов. При этом теряется седиментационная устойчивость и далее происходит разделение фаз, т. е. разрушение дисперсной системы.
99
Таким образом, агрегативная устойчивость – это способность системы к сохранению дисперсности и индивидуальности частиц дисперсной фазы. Возникающие в результате потери агрегативной устойчивости коагулянты представляют собой осадки (или всплывающие образования) различной структуры – плотные, творожистые, хлопьевидные, кристаллоподобные.
Взависимости от механизма процесса образования дисперсные системы по классификации Ребиндера П.А. подразделяются на два типа: лиофильные и лиофобные. Лиофильные дисперсные системы получаются при самопроизвольном диспергировании одной из фаз. Лиофобные дисперсные системы получаются в результате диспергирования (принудительное образование гетерогенной свободнодисперсной системы).
Лиофобные системы обладают избытком поверхностной энергии, поэтому в них самопроизвольно идут процессы укрупнения частиц, т.е. происходит уменьшение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы называют агрегативно неустойчивыми.
Вагрегативно неустойчивых системах процесс укрупнения идет двумя путями. Первый путь – изотермическая перегонка – заключается в переносе вещества от мелких частиц к крупным, так как химический потенциал последних меньше. В результате мелкие частицы постепенно растворяются (испаряются), а крупные растут. Второй путь, наиболее характерный и общий для дисперсных систем, представляет собой коагуляцию, заключающуюся в слипании частиц дисперсной фазы. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости системы. Процесс слияния частиц получил название коалесценции.
Первый этап коагуляции состоит в сближении частиц дисперсной фазы и взаимной их фиксации на небольших расстояниях друг от друга. Между частицами остается прослойка среды. В результате образуются или флоккулы (флокуляция – образование агрегатов из нескольких частиц, разделенных прослойками среды), или коагуляционные структуры, отличающиеся подвижностью частиц относительно друг друга. Обратный процесс образования устойчивой свободнодисперсной системы из осадка или геля (структурированной дисперсной системы) называется пептизацией. Более глубокий процесс коагуляции приводит к разрушению прослоек среды и не-
100
посредственному контакту частиц, в результате образуются жесткие агрегаты из твердых частиц.
Агрегативная устойчивость нестабилизированных лиофобных дисперсных систем носит кинетический характер, т. е. она характеризуется скоростью процессов, вызываемых избытком поверхностной энергии. Скорость коагуляции определяет агрегативную устойчивость дисперсных систем.
Агрегативная устойчивость может носить и термодинамический характер, если дисперсная система не обладает избытком поверхностной энергии. В этом случае в системе не происходит коагуляция.
5.2.Факторы агрегативной устойчивости
Всоответствии с вышеизложенной классификацией различают
термодинамические и кинетические факторы устойчивости дисперсных систем.
Так как движущей силой коагуляции является избыточная поверхностная энергия, то основными факторами устойчивости являются те, которые снижают поверхностное натяжение. Эти факторы относятся к термодинамическим факторам. К термодинамическим факторам относятся следующие факторы:
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц, значит в уменьшении по-
верхностной энергии Gs s , что увеличивает агрегативную ус-
тойчивость дисперсных систем. При сближении частиц с двойным электрическим слоем двойные электрические слои перекрываются, возникают силы электростатического отталкивания, препятствующие слипанию частиц.
2. Адсорбционно-сольватный фактор. При взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации) на поверхности частиц возникают адсорбционно-сольватные слои из молекул дисперсной среды. При этом происходит уменьшение межфазного натяжения и уменьшение поверхностной энергии.
Адсорбционно-сольватные слои препятствуют сближению частиц и их слипанию. При сближении частиц сольватные слои перекрываются, возникает осмотическое давление, а с ним и давление
