
Поверхностные явления и дисперсные системы
.pdf101
отталкивания. Этот фактор доминирует в лиофильных системах и является весьма сильным, обеспечивающим устойчивость систем с высоким содержанием дисперсной фазы.
3. Энтропийный фактор. Сущность его состоит в стремлении дисперсной фазы к равномерному распределению по всему объему системы (при этом энтропия системы возрастает). При сближении частиц возрастает упорядоченность в системе, уменьшается хаотичность и энтропия уменьшается. А в самопроизвольном процессе энтропия возрастает, поэтому частицы расходятся и стремятся распространиться по всему объему системы.
Кинетические факторы, снижающие скорость коагуляции, связаны в основном с гидродинамическими свойствами среды: с замедлением сближения частиц, вытекания и разрушения прослоек среды между ними. К кинетическим факторам относятся:
1.Структурно-механический фактор. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью (поверхностно-активные вещества или высокомолекулярные соединения), разрушение которых требует затрат энергии и времени. При сближении частиц эти пленки препятствуют их слипанию. Часто после разрушения пленки не восстанавливаются, так как находятся в равновесии со средой.
2.Гидродинамический фактор определяется скоростью сближения частиц и скоростью вытекания прослоек дисперсионной среды между ними. Можно снизить скорость коагуляции благодаря повышению вязкости и плотности дисперсной фазы и дисперсионной среды.
3.Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно – смешанные факторы. Особенно высокая устойчивость наблюдается при совокупности действий термодинамических и кинетических факторов, когда наряду со снижением межфазного натяжения проявляются механические свойства межчастичных прослоек.
Необходимо учитывать, что каждому фактору устойчивости соответствует специфический метод его нейтрализации. Действие электростатического фактора можно изменить введением электролита, вызывающего сжатие ДЭС. Сольватация может быть исключена с помощью адсорбции соответствующих веществ. Действие структурно-механического фактора можно уменьшить с помощью
102
веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц.
5.3. Теория устойчивости гидрофобных (лиофобных) дисперсных систем. Теория ДЛФО
Впроцессе развития коллоидной химии возникло немало теорий, которые пытались связать устойчивость гидрофобных золей с параметрами системы и явлениями, возникающими при взаимодействии дисперсной фазы с дисперсионной средой.
Современная теория устойчивости, разработана Дерягиным совместно с Ландау. Несколько позже почти аналогичная разработка была сделана независимым путем Фервеем и Овербеком. Поэтому современная теория устойчивости была названа по первым буквам фамилий ученых теорией ДЛФО.
Воснове теории устойчивости лежит соотношение между силами притяжения и отталкивания частиц. Силы притяжения обусловлены межмолекулярными силами Ван-дер-Ваальса, силы отталкивания по своей природе являются электростатическими.
Взависимости от баланса этих сил в тонкой прослойке жидкости между сближающимися частицами возникает либо положитель-
ное Éрасклинивающее® давление П 0 , препятствующее их соединению, либо отрицательное П 0 , приводящее к утончению прослойки и образованию контакта между частицами (коагуляции).
Расклинивающее давление П – это то избыточное давление,
которое обнаруживает межфазная прослойка жидкости при ее утоньшении. Итак, при сближении коллоидных частиц на достаточно малое расстояние гидростатическое давление в прослойке отличается от давления в окружающей жидкости на величину расклинивающего давления, которое сильно зависит от h – толщины прослойки.
Расклинивающее давление – суммарный параметр, учитывающий как силы отталкивания Пэ , так и силы притяжения П м
П Пэ П м . |
(5.1) |
103
Рассмотрим природу сил, определяющих расклинивающее давление и зависимость П f h .
Взаимодействие крупных частиц можно рассматривать как взаимодействие между плоскими параллельными пластинами, т. е. можно принять, что линейный размер частиц значительно больше толщины двойного электрического слоя.
Общая энергия взаимодействия между двумя пластинами U , приходящаяся на единицу их площади, равна
U U э U м , |
(5.2) |
где U э – энергия электростатического отталкивания; U м – энергия молекулярного притяжения.
Каждую из этих энергий можно выразить как функцию расстояния h между частицами.
Значение энергии отталкивания равно |
|
U э Ae ah , |
(5.3) |
где A и a – сложные величины, зависящие от многих факторов. Энергия отталкивания является положительной величиной и
возрастает с уменьшением расстояния h между частицами по экспоненциальному закону.
Энергия притяжения является отрицательной величиной согласно уравнению
U м |
|
A12 |
|
A |
, |
(5.4) |
|
h2 |
|||||
|
12 h2 |
|
|
|
||
где A12 – константа Гамакера, учитывает природу взаимодействующих тел, A12 10-19 Дж;
|
A12 |
. |
(5.5) |
|
|||
A |
|
12
104
Энергия притяжения между частицами значительно медленнее уменьшается с увеличением расстояния между частицами, чем энергия отталкивания. Знак расклинивающего давления определяется знаком общей энергии взаимодействия
U( h ) U э U м Ae ah |
A |
. |
(5.6) |
|
|||
|
h2 |
|
|
Устойчивость дисперсных систем или скорость коагуляции зависит от знака и значения общей потенциальной энергии взаимодействия частиц.
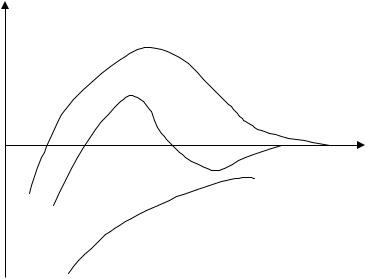
Положительная энергия отталкивания U э с увеличением расстояния уменьшается по экспоненциальному закону, а отрицательная энергия притяжения U м обратно пропорциональная квадрату расстояния. Поэтому в результате на малых (при h 0, U э const , U м ) и больших расстояниях (экспонента убывает значительно быстрее, чем степенная функция) между частицами преобладает энергия притяжения, а на средних расстояниях – энергия электростатического отталкивания. В этом случае на кривой U f ( h ) будет на средних расстояниях наблюдаться максимум, а на малых и больших расстояниях между частицами будут наблюдаться два минимума (šямыŸ): первый минимум (I) и второй минимум (II) (рис.5.1).
Первый минимум отвечает непосредственному слипанию частиц, а второй – их притяжению через прослойку среды. Максимум на средних расстояниях характеризует потенциальный барьер W , препятствующий слипанию частиц. Возможность сближения частиц определяется высотой потенциального барьера и глубиной ям.
Рассмотрим три наиболее типичных случая:
1. На любом расстоянии между частицами энергия притяжения преобладает над энергией отталкивания, энергия потенциального барьера W = 0. Для дисперсной системы, находящейся в таком состоянии, характерна быстрая коагуляция с образованием агрегатов в первом минимуме (I) в результате близкого взаимодействия частиц (рис. 5.2, кривая 1). Элементарный акт коагуляции происходит в результате ближнего взаимодействия частиц. Такие системы неустойчивы и коагуляция часто необратима.

105
U
UÊ h
U h
W
h
II
I |
U ¾ h |
|
Рис. 5.1. Зависимость энергии электростатического отталкивания UÊ , энергии молекулярного притяжения U ¾ и общей энергии взаимодействия частиц U от расстояния h
2.Кривая 2 указывает на наличие достаточно высокого потенциального барьера и вторичного минимума (II). В системе, находящейся в таком состоянии, происходит быстрая флокуляция частиц на расстояниях, соответствующих вторичному минимуму. Благодаря наличию потенциального барьера частицы во флокулах не имеют непосредственного контакта и разделены прослойкой среды. Коагуляция в этом случае обратима.
Обратный процесс – пептизация возможна после устранения вторичного минимума. Существование вторичного минимума, предсказанное теорией ДЛФО, приводит к весьма важному следствию: образованию систем золь – гель, обладающих относительной устойчивостью и обратимостью.
3.Кривая 3 отвечает состоянию системы с высоким потенциальным барьером при отсутствии вторичного минимума. Вероятность образования агрегатов в таких условиях очень мала и дисперсные системы обладают агрегативной устойчивостью. Частицы хотя и сталкиваются, но их энергии не хватает для преодоления большого потенциального барьера. При наличии первичного минимума системы термодинамически неустойчивы. Более выгодное энергетическое положение для частиц в первом минимуме, но оно недоступно для частиц.
106
U
3
2
h
II
1
I
Рис. 5.2. Потенциальные кривые для дисперсных систем с разной степенью и характером устойчивости
Высота потенциального барьера, а соответственно и устойчивость к коагуляции повышается с увеличением размера частиц. Увеличение размера частиц приводит к возрастанию глубины второго энергетического минимума.
Это подтверждается тем, что процессы дальней агрегации особенно распространены в грубодисперсных системах, например, в пастах и цементных растворах. Фиксация частиц во вторичном минимуме может привести при достаточной концентрации дисперсной фазы к превращению золя в полностью структурированную систему.
5.4. Коагуляция дисперсных систем
Коагуляция коллоидных систем может происходить под влиянием следующих факторов: изменение концентрации дисперсной фазы, изменение температуры, механические воздействия, жесткие излучения, химические реагенты. Коагуляция также возможна при старении дисперсной системы.
Во всяком процессе коагуляции различают две стадии:
1.скрытая коагуляция – невооруженным глазом нельзя наблюдать каких-либо внешних признаков происходящих изменений в золе;
107
2.явная коагуляция – о коагуляции можно судить невооруженным глазом (по помутнению, по выпадению осадка, по изме-
нению цвета).
Для лиофобных золей характерно, что стадия скрытой коагуляции очень коротка и быстро переходит в стадию явной коагуляции. Однако наиболее важное теоретическое и практическое значение имеет коагуляция золей при добавлении электролитов.
На основании экспериментального изучения действия электролитов на золь сформулированы основные правила электролитной коагуляции:
1. Коагуляцию коллоидного раствора способны вызвать все
сильные электролиты при определенной концентрации, достаточной для сжатия ДЭС, понижения – потенциала и потенциального барьера.
2.Правило знака. Коагулирующим действием обладают ионы, знак заряда которых противоположен знаку заряда коллоидной частицы (или одинаков со знаком противоионов). Ион, вызывающий коагуляцию, называется ион-коагулятором. Это правило установил
в1900 г. Гарди. Таким образом, золь с отрицательно заряженными частицами будет коагулироваться положительными ионами электролита. Положительные ионы вдавливают противоионы в плотный слой, при этом сжимается ДЭС.
3.Порог коагуляции – это наименьшая концентрация электролита c» , при которой начинается коагуляция коллоидного раствора,
определяется по уравнению
ск |
V c |
, ммоль/дм3, |
(5.7) |
|
|||
|
W |
|
|
где V – объем электролита; c – концентрация |
электролита, |
||
ммоль/дм3; W – объем золя. |
|
||
Начало коагуляции может быть определено по изменению окраски золя, появлению мути, началу выделения дисперсной фазы в
осадок и т.д. |
|
||
4. Коагулирующая сила (способность) электролита – |
вели- |
||
чина, обратная порогу коагуляции |
|
||
|
1 |
. |
(5.8) |
|
|||
|
cк |
|
|
108
5. Влияние заряда (валентности) ион-коагулятора. Коагулирующая сила электролита очень сильно возрастает с увеличением валентности ион-коагулятора. Ион-коагуляторы с высшей валентностью обладают меньшим порогом коагуляции (правило Шульца – Гарди). Значения порогов коагуляции, вызываемой электролитами с зарядом ион-коагулятора 1, 2, 3, относятся как
c» 1 : ¯» 2 : ¯» 3 |
|
|
1 |
6 |
1 6 |
|
||||||
1: |
|
|
|
: |
|
|
|
, |
(5.9) |
|||
2 |
3 |
|||||||||||
то есть |
|
|
|
|
|
|
|
|
||||
|
Ë |
|
|
|
|
|
|
|
|
|
||
¯ |
, |
|
|
|
|
|
|
|
(5.10) |
|||
|
|
|
|
|
|
|
|
|||||
» |
|
Z 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где а – некоторая константа; Z –заряд ион-коагулятора.
6. Коагулирующая сила ион-коагуляторов одной и той же валентности возрастает с увеличением радиуса ион - коагулятора.
7. Правило о критическом потенциале. Явная коагуляция наступает, как правило, при критическом - потенциале. Для многих систем значение критического - потенциала составляет 30 мВ. Если значения электрокинетического потенциала находятся в пределах от 30 до 70 мВ, то золь считается устойчивым.
5.5. Теория коагуляция электролитами
При рассмотрении коагуляции коллоидных систем следует различать два предельных случая: нейтрализационную и концентрационную коагуляцию.
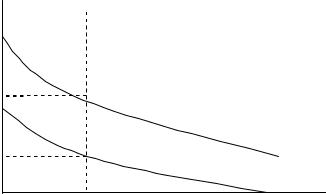
1. Нейтрализационная коагуляция наблюдается, когда потеря устойчивости происходит в результате разряжения коллоидных частиц вследствие уменьшения адсорбции потенциалопределяющих ионов и уменьшения o - потенциала и - потенциала (рис. 5.3). При низком значении o - потенциала исчезает потенциальный барьер, и коагуляция происходит в первичном минимуме. Нейтрализационная коагуляция наблюдается у золей со слабо заряженными частицами.
|
109 |
|
|
|
|
0 1 |
|
|
1 |
|
|
0 2 |
1 |
|
2 |
2 |
|
|
|
|
Рис. 5.3. Изменение значения потенциала 0 |
и - по- |
|
тенциала при нейтрализационной коагуляции |
||
2. Концентрационная коагуляция наблюдается, когда потеря устойчивости вызвана сжатием двойного электрического слоя (рис.4.5). Концентрационная коагуляция наблюдается обычно у золей, частицы которых имеют значительный заряд, при увеличении концентрации индифферентного электролита в системе. В этом случае при сжатии ДЭС уменьшается - потенциал, а также уменьшается толщина ионных атмосфер. Одновременно в результате сжатия ДЭС увеличивается глубина вторичного минимума, что приводит к коагуляции через прослойку среды (флокуляции) во вторичном минимуме.
5.6. Кинетика коагуляции
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах. Об агрегативной устойчивости этих систем судят по скорости коагуляции.
Скорость коагуляции – это изменение частичной концентрации в единицу времени в единице объема dv / dt .
Различают быструю коагуляцию, когда каждое столкновение частиц приводит к их слипанию (теория разработана С. Смолуховским), и медленную коагуляцию, когда не все столкновения приводят к коагуляции (теория Н. Фукса).
Теория быстрой коагуляции Смолуховского. Была рассмотрена коагуляция монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского дви-
110
жения. При коагуляции первоначально одинарные частицы, сталкиваясь друг с другом, образуют двойные частицы; двойные, сталкиваясь с одинарными частицами, образуют тройные частицы и т. д.
Так как при быстрой коагуляции каждое столкновение приводит к слипанию частиц, то механизм быстрой коагуляции можно сравнить с механизмом реакции второго порядка. Тогда скорость коагуляции должна быть пропорциональна квадрату численной концентрации частиц v :
|
dv |
kv2 |
, |
(5.11) |
|
||||
|
dt |
|
|
|
|
|
|
|
Слева поставлен знак минус, так как скорость положительна, а концентрация частиц во времени уменьшается (производная отрицательная). Разделяем переменные и интегрируем
|
v |
|
dv |
|
|
t |
|
|||
|
|
|
|
|
|
|
|
kdt , |
(5.12) |
|
|
|
v |
2 |
|
||||||
|
v |
|
0 |
|
||||||
получаем |
0 |
|
|
|
|
|
|
|
||
|
|
1 |
|
|
1 |
|
|
|||
|
|
|
|
|
kt . |
(5.13) |
||||
|
|
v |
|
|||||||
|
|
|
v0 |
|
||||||
где v0 – первоначальное число частиц в дисперсной системе (исходная концентрация частиц золя до начала коагуляции).
Отсюда получаем выражение константы скорости коагуляции
1 |
|
1 |
1 |
|
|
|||
k |
|
|
|
|
|
|
. |
(5.14) |
t |
|
v |
||||||
|
v |
|
|
|
||||
|
|
|
|
|
0 |
|
|
|
Выражаем численную концентрацию (количество частиц в единице объема) золя к моменту времени t
v |
|
v0 |
. |
(5.15) |
|
1 ktv0 |
|||||
|
|
|
|
Найдем выражение для константы k и подставим его в уравнение (5.15), так как теоретически эту константу определить трудно. Смолуховский ввел понятие времени половинной коагуляции
