
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

22 :: 23 :: Содержание
2.3. Вода
Вода непосредственно и самым тесным образом участвует во всех физиологических процессах, но именно из-за того, что она столь вездесуща, ее роль часто недооценивают, считая ее просто инертным "наполнителем" в живых системах. Однако вода-это чрезвычайно реакционноспособное вещество, совершенно не похожее по своим физическим и химическим свойствам на большинство других жидкостей. Она обладает необычными свойствами, очень важными для живых систем. И если бы эти свойства у вода отсутствовали, жизнь, насколько мы можем судить, была бы невозможна. Первые живые системы возникли предположительно в водной cреде мелких морей. Неудивительно поэтому, что современные живые организмы отлично приспособлены на молекулярном уровне к специфическим свойствам воды. Даже сухопутные животные на 75% или более состоят из воды и обладают физиологическими механизмами, направленными на сохранение воды в организме и на регуляцию химического состава внутренней водной среды.
Специфические свойства воды, которые так важны для жизни, являются прямым следствием ее молекулярной структуры; рассмотрим поэтому вкратце, что из себя представляет молекула воды.
2.3.1. Молекула воды
Атомы в молекуле воды удерживаются вместе посредством полярных ковалентных связей, которые связывают один атом кислорода с двумя атомами водорода. Полярность ковалентных связей (т. е. неравномерное распределение заряда) в данном случае объясняется сильной электроотрицательностью атома кислорода по отношению к атому водорода. Это есть проявление сильного стремления со стороны атома кислорода "оттянуть" электроны от других атомов, в том числе от атома водорода. Такая значительная электроотрицательность приводит к тому, что электроны обоих атомов водорода в молекуле воды занимают положения в пространстве, статистически более близкие к атому кислорода, чем к "родительским" атомам водорода. Поэтому данная связь примерно на 40% является ионной по своей природе, а возникшие в результате дробные заряды распределены в молекуле следующим образом (δ соответствует локальному дробному заряду на каждом атоме водорода):
Молекулу воды можно изобразить также, исходя из представлений о молекулярных орбиталях (рис. 2-9). Угол между двумя связями О-Н в молекуле воды оказывается равным не 90°, как это должно быть в случае чисто
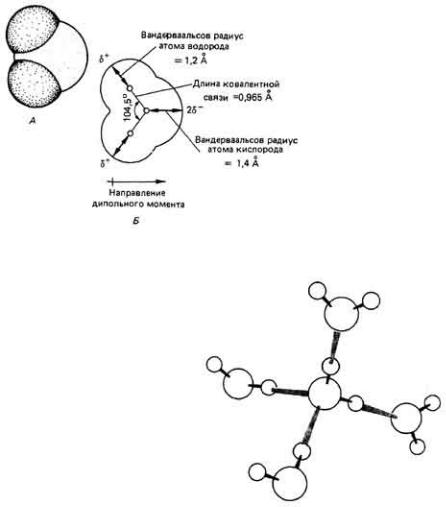
ковалентного связывания, а 104,5°. Это объясняется взаимным отталкиванием положительно заряженных ядер атомов водорода, стремящимся раздвинуть их как можно дальше. В молекуле сероводорода, H 2S, связи S-Н носят чисто ковалентный характер; в ней отсутствует асимметрия в распределении заряда, наблюдаемая в молекуле Н2О. Поэтому в H2S валентный угол ближе к 90°. Из-за полуполярной природы связей Н-О вода сильно отличается по своим
22
Рис. 2.9. Схематические изображения молекулы воды,
показывающие взаимосвязи между атомами кислорода и водорода в молекуле. А. Объемная модель. Б. Длины связей и углы между ними. (Lehninger, 1975.)
Рис. 2.10. Тетраэдрическое расположение водородных связей между молекулами воды.
химическим и физическим свойствам от H2S и других гидридов, образованных элементами того же столбца периодической таблицы. Почему же так происходит?
Неравномерное пространственное распределение электронов в молекуле воды из-за полуполярной природы связи Н- О приводит к тому, что молекула воды ведет себя как диполь. В этом смысле она похожа на магнит в виде стержня, только последний имеет два разноименных магнитных полюса, а у диполя два разноименных электрических полюса ( + и -) (рис. 2-9). Поэтому диполь стремится ориентироваться вдоль электростатического поля. Чем больше диполъный момент, тем больше силы, стремящиеся повернуть молекулу во внешнем поле. Большой дипольный момент молекулы воды (4,8 дебая)-это самая важная физическая особенность молекулы, объясняющая многие весьма специфические свойства воды.
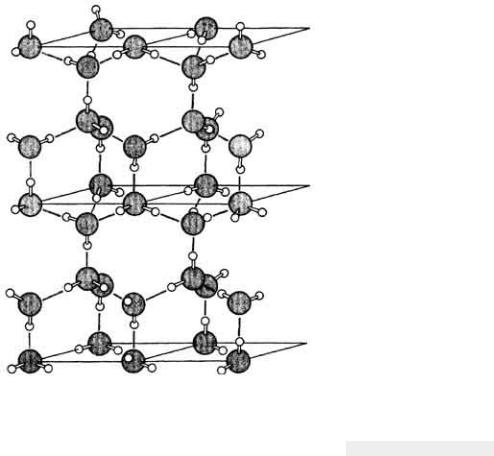
Наиболее важной химической особенностью воды является способность ее молекул образовывать между собой водородные связи, т.е. связи, которые образуются между положительно заряженными протонами (атомами водорода) одной молекулы воды и отрицательно заряженными (ввиду избытка электронов) атомами кислорода соседних молекул воды (рис. 2-10). В каждой молекуле воды четыре из восьми электронов внешней оболочки атома кислорода ковалентно связаны с двумя атомами водорода. Остаются еще две пары электронов, которые могут взаимодействовать электростатически (т. е. образовывать водородные связи) с электрондефицитными атомами водорода соседних молекул воды. Поскольку угол между ковалентными связями в молекуле воды составляет около 105°, группы связанных водородными связями молекул воды образуют тетраэдрические структуры. Такое расположение молекул лежит в основе кристаллической структуры наиболее распространенной формы льда (рис. 2-11).
Рис. 2.11. Кристаллическая структура льда. (Loewy, Siekevitz, 1969.)
23
22 :: 23 :: Содержание

24 :: Содержание
2.3.2. Свойства воды
Образованная с участием водородных связей структура воды очень неустойчива-время жизни водородной связи в жидкой воде составляет всего около 10-10-10-11 с. Это обусловлено тем, что водородная связь принадлежит к категории относительно слабых связей. Чтобы разорвать ее, требуется энергия всего лишь 4,5 ккал/моль, тогда как энергия ковалентной связи О-Н в молекуле воды составляет 110 ккал/моль. В результате любое конкретное распределение связей между молекулами Н2О сохраняется лишь очень непродолжительное время, какой-то миг, однако при постоянной температуре доля молекул, связанных водородными связями со своими соседями, постоянна во времени изза статистического усреднения.
Несмотря на свою относительную слабость, водородные связи увеличивают полную энергию (т.е. количество тепла), которую необходимо затратить на отделение индивидуальной молекулы от остальной массы. По этой причине
температуры плавления и кипения и теплота парообразования у воды гораздо выше, чем у других простых гидридов разных элементов, выступающих в роли кислорода (например, NH3, HF, H2S). Из всех простых гидридов только у воды точка кипения (100°С) лежит значительно выше тех температур, которые характерны для поверхности Земли. Статистический, лабильный характер связывания между собой молекул воды является также причиной того, что вода имеет необычайно высокие когезионную способность и коэффициент поверхностного натяжения.

Рис. 2.72. А. Внутренняя структура кристаллической решётки
хлористого натрия.
Б. Структура, построенная с учетом относительных размеров ионов Na+ и Сl-. (Mohan, 1966.)
Мало кто сомневается в том, что моря и озера являли бы собой сплошные толщи льда, исключая тонкий слой воды на поверхности, если бы лед был плотнее (а стало быть, тяжелее) воды и нарастал снизу вверх, а не сверху вниз. Лед имеет меньшую плотность по сравнению с водой, потому что обладает рыхлой кристаллической структурой, тогда как у воды в силу ее менее упорядоченной молекулярной организации молекулы расположены в среднем ближе друг к другу, т.е. упакованы плотнее.
24
24 :: Содержание
