
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

38 :: 39 :: 40 :: 41 :: 42 :: 43 :: 44 :: Содержание
2.8.3. Белки
Из всех органических молекул белки являются наиболее сложными и представляют наиболее многочисленный класс молекул в живой клетке; на их долю приходится более половины клеточной массы в сухом весе. Белковые молекулы представляют собой линейные цепи из остатков аминокислот (табл. 2-7). Вся информация, закодированная в генетическом материале клетки, переводится в первую очередь на язык первичной структуры (см. ниже) белковых молекул; выстраиваемая в процессе белкового синтеза
аминокислотная последовательность служит выражением этой информации и определяет
38
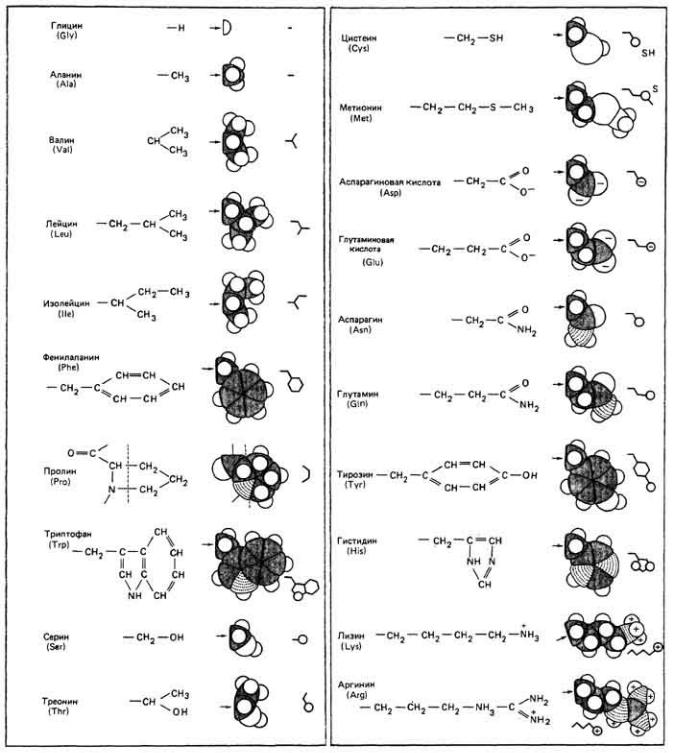
Т а б л и ц а 2 - 7 . Боковые группы, или радикалы (см. рис. 2-35), двадцати обычных а-аминокислот (Higgis et aL, 1965)
39
Т а б л и ц а 2 - 8. Классификация белков на основе их биологической функции (Lehninger, 1975)

свойства любой белковой молекулы. Число разных аминокислотных строительных блоков равно примерно 20, поэтому существует колоссальное множество различных вариантов аминокислотных последовательностей. Предположим, например, что нам нужно построить полипептидную молекулу, состоящую всего из 20, но отличных друг от друга, аминокислот. Сколько различных перестановок аминокислот в полимерной цепи мы можем осуществить, чтобы ни одна последовательность не повторилась дважды? Ответ выражается произведением 20·19·18·17·16·...-.2·1 (=20!), т.е. составляет ~1018.
Но даже эта умопомрачительная величина блекнет в сравнении с реальностью, если мы вспомним, что полипептид, содержащий всего 20 аминокислот, является относительно небольшой молекулой (ее масса составляет около 2400). Для более типичной молекулы белка с мол. массой 35000, содержащей всего 12 разновидностей аминокислот, число возможных последовательностей превышает 10300. Поэтому неудивительно, что число известных ферментов (которые все суть белки) превысило 1000, и, вероятно, немало новых ферментов еще предстоит открыть.
Ферменты образуют самую большую функциональную группу белков, однако существует много других белков, не являющихся ферментами, и все они кодируются и транскрибируются посредством одних и тех же генетических

механизмов. В табл. 2-8 приводится классификация белков на основе их биологических функций и дано небольшое число примеров.
40
Рис. 2.35. А. Обобщенная структура α-аминокислот; R-боковая
группа (радикал). Б. Боковые группы некоторых аминокислот (см. также табл. 2-7.).
Все аминокислоты, из которых построены белки, являются молекуламиа альфа(α)-типа, поскольку в каждой из них аминогруппа находится при атоме α- углерода соответствующей молекулы. Эти 20 обычных аминокислот отличаются друг от друга структурой боковых групп (рис. 2-35). Боковые группы служат буквами в белковом алфавите точно так же, как пуриновые и пиримидиновые основания образуют молекулярный алфавит нуклеиновых кислот. Специфическая линейная последовательность аминокислотных остатков в полипептидной молекуле называется ее первичной структурой. Аминокислотные остатки полипептидной цепи соединены со своими соседями ковалентными пептидными связями с образованием плоских амидных групп. Пептидная связь образуется путем конденсации, при которой отщепляется молекула воды. Белковая молекула может состоять из одной, двух или нескольких полипептидных цепей, удерживаемых вместе ковалентными либо более слабыми связями.
Первичная структура полипептидной цепи задает ту пространственную конформацию, которую молекула будет иметь в конкретной окружающей среде. Эта конформация зависит от типа и положения боковых групп, выступающих из полипептидного остова. Кроме первичной структуры (т.е. аминокислотной последовательности) существуют еще дополнительные конформационные уровни, называемые вторичным, третичным и четвертичным.
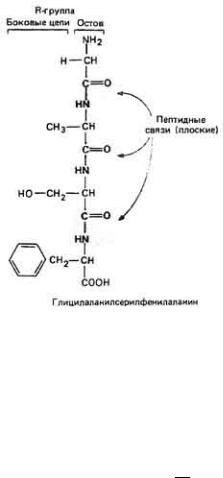
Рис. 2.36. Трипептид. Показан плоский характер пептидных связей.
Под вторичной структурой понимают конформацию полипептидной цепи, п о д третичной структурой - сворачивание цепи, в результате которого получаются глобулярные или стержнеобразные молекулы, а под четвертичной структурой- соединение двух или более белковых молекул с образованием димеров, тримеров и, в ряде случаев, даже более крупных агрегатов.
Из-за промежуточного характера связи C...N, которая является не чисто одинарной, а отчасти двойной, свободное вращение вокруг нее фактически запрещено; по этой причине атомы амидной группы вынужденно находятся в одной плоскости (рис. 2-36). Остаются только две связи из трех, образующих пептидный остов, вокруг которых возможно свободное вращение. Лайнус Полинг и Роберт Кори в 1953 г., используя точные пространственные модели молекул, учитывающие взаимное расположение и размеры атомов, обнаружили, что самым простым вариантом стабильной конформации является спираль, показанная на рис. 2-37. В этой так называемой α-спирали плоскости всех амидных групп параллельны главной оси спирали и на один ее виток приходится 3,6 аминокислотных остатков. Боковые группы всех аминокислот выступают из остова наружу и могут взаимодействовать с другими боковыми группами или другими молекулами. Стабильность α-спирали существенно возрастает при образовании водородных связей между атомом кислорода карбонильной группы и атомом
41
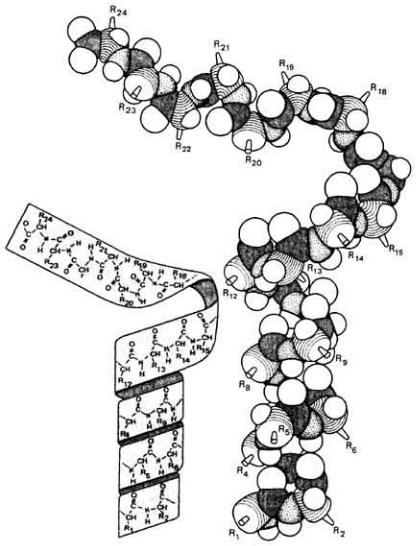
Рис. 2.37. Белковая α-спиралъ с шагом 3,6 аминокислотных остатков на виток. В верхней части молекулы полипептидная цепь развернута. (Haggis et at., 1964.)
водорода амидной группы, отстоящей от данной на четыре остатка вдоль цепи (рис. 2-38). Таким образом, полипептидная цепь принимает конформацию α- спирали самопроизвольно при условии, что этому не мешают боковые группы. Длинные пептидные цепи с ненарушенной конформацией α-спирали характерны для фибриллярных белков, подобных тем, которые составляют основу волос, ногтей и клыков, шерсти, рогов и перьев. Шелк, вырабатываемый гусеницами, является исключением, поскольку вторичная структура его волокон образована складчатыми слоями [бета(β)-кератин], а не α-спиралью.
Внутриклеточные белки, которые не несут чисто структурных функций, имеют более или менее глобулярную конформацию. Такие глобулярные белки также содержат а-спирали, но их длина относительно невелика. В этих белках полипептидная цепь образует трехмерную глобулу. Характер третичной структуры в значительной мере определяется свойствами некоторых боковых групп аминокислот. Например, в боковой группе пролина (рис. 2-39) вращение вокруг связи N-С невозможно (хотя последняя и не принадлежит к пептидной связи), поскольку атом азота является частью жесткой циклической структуры. Таким образом, как только пролин (или гидроксипролин) встречается в полипептидной цепи, происходит деформация а-спирали и полипептидный остов изгибается -на некоторый угол, способствуя тем самым образованию

глобулярной конформации. Другой фактор, влияющий на третичную структуру белка, - наличие
42
Рис. 2.38. Водородные связи между атомом кислорода карбонильной группы и атомом водорода амидной группы четвертого (по ходу цепи) аминокислотного остатка в α-спирали белка. (Loewy, Siekevitz, 1969.)
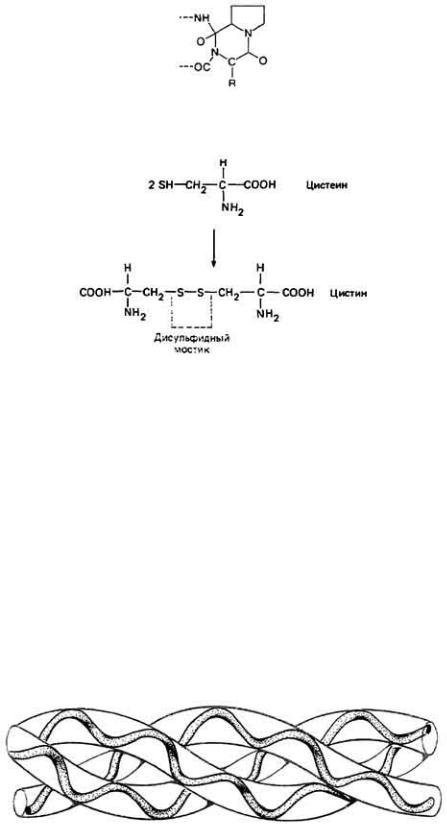
электрического заряда на отдельных боковых группах и возникающие в результате кулоновские (электростатические) взаимодействия этих групп с другими боковыми группами. Специального упоминания заслуживает боковая группа цистеина. Сульфгидрильная группа (т. е. -SH) играет важную роль в ковалентном сшивании белковой структуры (соединении двух отдельных полипептидных цепей или фиксации цепи в сложенном состоянии), поскольку два остатка цистеина могут соединиться друг с другом, образуя дисульфидный мостик (рис. 2-40). Сульфгидрильная группа весьма реакционноспособна, поэтому неудивительно, что в активных центрах ферментов часто присутствуют один или более остатков цистеина. Токсичность ртути и других тяжелых металлов объясняется отчасти тем, что они реагируют с атомом серы цистеина, замещая атом водорода. Такая реакция может "отравить" (т.е. лишить
каталитической способности) активный центр фермента.
Рис. 2.39. Схема, показывающая, каким образом остаток пролина может изменить направление полипептидной цепи, создавая "изломы" в структуре а-спирали и влияя тем самым на конформацию белковой молекулы.
Рис. 2.40. Образование дисулъфидной связи, имеющее важное значение для формирования третичной структуры белка путем сшивания разных участков полипептидных цепей.
Помимо наличия ковалентных сшивок -S-S- между остатками цистеина третичная структура белка самым непосредственным образом зависит от конформации некоторых остатков, кулоновских и вандерваальсовых взаимодействий, водородных связей. Последние три типа связей относительно слабы и термолабильны. Вот почему нагревание белка приводит к его денатурации, т.е. вызывает деформацию и разрушение его третичной структуры. Высокие температуры способны инактивировать ферменты и являются, таким образом, гибельными для живых клеток.
Важное свойство белков заключается в их способности к самосборке. Аминокислотная
43
Рис. 2.41. Четвертичная структура белка коллагена, состоящая из трех а-спиралей, каждая из которых закручена в "сверхспираль". Сверхспирали удерживаются вместе водородными связями. (Dowben, 1971.)
последовательность полипептидной цепи (и, следовательно, относительные положения различных аминокислотных боковых групп) не только определяет вторичную и третичную структуры молекулы, но и обусловливает появление участков, способных специфически взаимодействовать с некоторыми другими белковыми молекулами; это позволяет нескольким разным молекулам

(субъединицам) собираться вместе и образовывать стабильные четвертичные комплексы (рис. 2-41). Такие взаимодействия могут происходить, если субъединицы имеют комплементарные участки, такие, что 1) отрицательно заряженные группы одной субъединицы оказываются напротив положительно заряженных групп другой субъединицы; 2) гидрофобные, неполярные боковые группы субъединиц, оказавшись рядом, совместно вытесняют молекулы воды. Ряд ферментов и другие белки представляют собой не единичные белковые молекулы, а состоят из молекулярных субъединиц, связанных друг с другом упомянутым выше способом, без образования ковалентных связей. Например, пигмент дыхательной системы гемоглобин состоит из четырех субъединиц: двух α- и двух β-полипептидных цепей (рис. 2-42, А). Эти молекулы самопроизвольно собираются в комплекс, если их по отдельности добавить в раствор и перемешать. Один из вариантов объединения субъединиц в комплекс показан на рис. 2-42, Б.
44
38 :: 39 :: 40 :: 41 :: 42 :: 43 :: 44 :: Содержание
