
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы
57 :: 58 :: Содержание
3.4. Температура и скорость реакции
Скорость химической реакции зависит от температуры. Это и неудивительно, поскольку температура - всего лишь проявление молекулярного движения. По мере повышения температуры растет средняя скорость молекул, а с ней - число соударений в единицу времени. Следовательно, увеличивается и вероятность такого взаимодействия между двумя молекулами, которое приводит к осуществлению реакции. Кроме того, с увеличением скорости молекул возрастает их кинетическая энергия, что также повышает вероятность того, что они прореагируют при соударении. Минимальная кинетическая энергия, которой должны обладать две молекулы в момент соударения, чтобы произошла реакция, называется свободной энергией активации или просто энергией активации. Она измеряется в кал/моль и соответствует количеству тепла, которое надо передать одному молю реагирующего вещества при данной температуре, чтобы все его молекулы (при равномерном распределении энергии) перешли в реакционноспособное, или активированное, состояние.
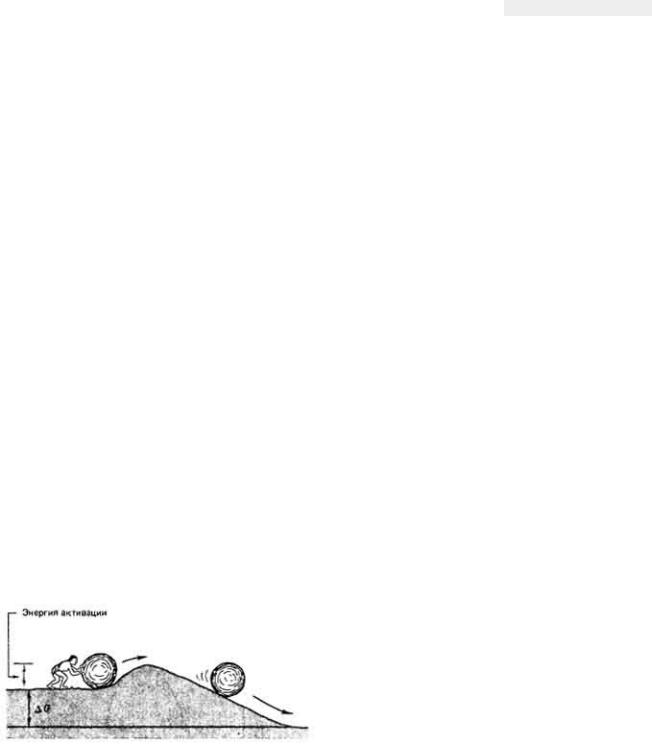
Понятие активации имеет смысл как для эндо-, так и для экзотермических. реакций. Даже в том случае, когда в результате реакции свободная энергия должна уменьшиться, реакция не пойдет, если реагирующие молекулы не будут обладать необходимой энергией. Это можно сравнить с такой ситуацией, когда нам нужно сбросить валун с вершины высокого холма, однако для того, чтобы он мог скатиться вниз, необходимо втащить его на невысокий гребень на вершине (рис. 3-10).
Рис. 3.10. Для того чтобы реагирующие вещества
пришли "в состояние готовности" к реакции, требуется затратить энергию активации. В той аналогии, которая здесь изображена, потенциальную энергию валуна не удастся реализовать до тех пор, пока не будет затрачена некоторая энергия на его перемещение на самую вершину холма.
Связь между свободной энергией и ходом реакции иллюстрирует рис. 3-11. Реагирующие вещества необходимо сначала перевести в состояние с большей энергией, достаточной для их активации, иначе они не смогут прореагировать. Поскольку реакция идет с убыванием свободной энергии, энергетический уровень продуктов реакции ниже, чем реагентов. Заметим, что результирующий прирост свободной энергии в реакции не зависит от высоты активационного барьера, который необходимо преодолеть, чтобы реакция могла осуществиться.
Во многих промышленных химических, процессах и скорость реакции, и энергия (или температура, что то же самое), необходимая для активации
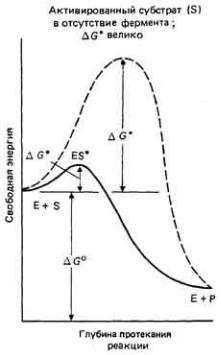
реагентов, существенно снижаются в присутствии катализаторов - веществ, которые не потребляются и не изменяются в ходе реакции, но присутствие которых облегчает взаимодействие реагирующих частиц. Аналогичным образом в живой клетке протеканию реакции способствуют биологические катализаторы, называемые ферментами. На рис. 3-11 показано, как при участии фермента уменьшается энергия активации. Заметим, что присутствие фермента никак не сказывается на результирующем приросте свободной энергии (и, следовательно, на константе равновесия) реакции-просто в этом случае возрастает скорость реакции.
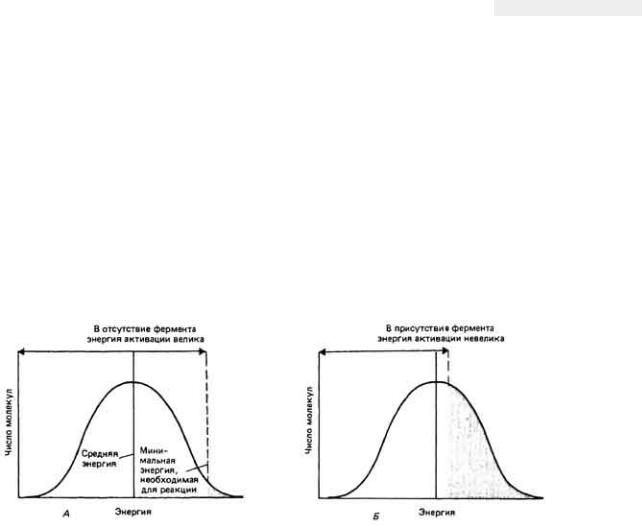
Увеличение скоростей реакций под действием ферментов имеет чрезвычайно важное биологическое значение, поскольку благодаря ферментам реакции (которые в противном случае протекали бы крайне медленно) могут осуществляться при физиологических температурах с теми скоростями, которые необходимы для нормального функционирования организма. На рис. 3-12, A представлено распределение частиц по скоростям при постоянной температуре. Энергией, достаточной для того, чтобы произошла реакция, обладают лишь самые
57
Рис. 3.11. Энергия -активации реакции ΔG* понижается за счет каталитического действия фермента. Заметим, что результирующий прирост свободной энергии ΔG° не зависит от того, присутствует фермент или отсутствует. Здесь Е-фермент, S-субстрат, ES - активированный фермент-субстратный комплекс.
быстрые молекулы (т.е. молекулы с наибольшей кинетической энергией; закрашенная площадь). Влияние катализатора иллюстрирует рис. 3-12, Б. Энергия, необходимая для активации молекул, уменьшилась, поэтому за тот же отрезок времени при той же температуре может прореагировать гораздо больше молекул. Ускорение реакций с помощью катализа для различных ферментов достигает значений от 108 до 1020.

Другое важное достоинство катализируемых реакций заключается в возможности регулировать скорость реакции, варьируя концентрацию катализатора. Например, при сжигании водорода в кислороде некаталитическим путем происходит неконтролируемая реакция и смесь взрывается, поскольку тепло, выделившееся при быстром сгорании части Н2, вызывает быстрое сжигание остальной части Н2. Если же водород окисляется медленно при относительно низкой температуре в присутствии небольших количеств платины в качестве катализатора, тепло выделяется достаточно медленно, поэтому взрыва не происходит. Изменяя количество платины по отношению к количеству топлива (Н2) и окислителя (О2), можно регулировать скорость сгорания. Точно так же большинство биологических реакций регулируется количеством, или активностью (т.е. каталитической эффективностью), соответствующего фермента.
58
57 :: 58 :: Содержание
58 :: 59 :: Содержание
3.5. Ферменты
Биологические катализаторы были впервые выделены из живых клеток в 1897 г. братьями Эдуардом и Гансом Бухнерами, которые получили их из водного экстракта дрожжей. Эти вещества повышали скорость спиртового брожения и инактивировались при повышении температуры, тогда как субстраты были невосприимчивы к тепловому воздействию. Это открытие явилось первым указанием на то, что ферментами могут быть молекулы белка. Далее было установлено, что все без исключения ферменты - это белковые молекулы с очень специфическими для каждой разновидности фермента аминокислотными составом и последовательностью. Все эти
Рис. 3.12.
Распределение молекул субстрата по энергиям имеет вид колоколообразной кривой. А. В отсутствие фермента лишь малое число молекул (закрашенная площадь) обладает энергией, равной или превышающей энергию активации. Б. Снижение активационного барьера в присутствии фермента приводит к значительному увеличению доли молекул Субстрата, у которых кинетическая энергия достаточно велика, чтобы реакция могла осуществиться. (Из работы Albert L. Lehninger. • Bioenergetics, 2nd ed., © 1971, by W.A. Benjamin, Inc., Menlo Park, California, с разрешения.)
58
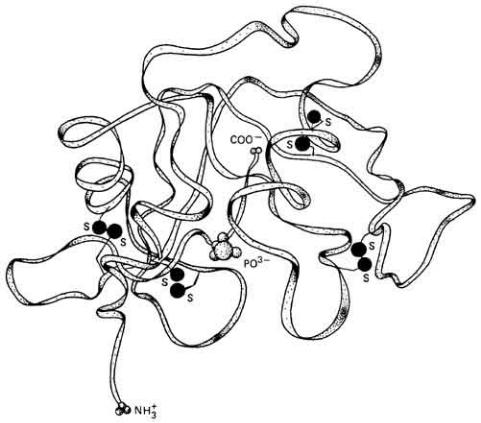
Рис. 3.13. Характерная для ферментов глобулярная структура иллюстрируется здесь на примере реконструированной молекулы рибонуклеазы из тканей быка. Изображен связанный с активным центром фосфат-ион. (Barry, Barry, 1969.) Дисульфидные связи соединяют остатки цистеина, отстоящие далеко друг от друга вдоль полипептидной цепи, и играют, таким образом, важную роль в стабилизации третичной структуры фермента.
молекулы или по крайней мере их участки, обладающие ферментативной активностью, имеют глобулярную конформацию (рис. 3-13). Каждая клетка содержит буквально тысячи разновидностей ферментов, и они катализируют не меньшее число реакций. В работах по молекулярной генетике было показано, что ферменты представляют собой первичные продукты генов и играют чрезвычайно важную роль, регулируя все процессы, связанные с синтезом и метаболизмом в клетке. Задавая заранее структуру каждой молекулы фермента, синтезируемой в клетке, генетический аппарат косвенно несет ответственность за все происходящие там ферментативные реакции.
Каталитическую эффективность (т. е. активность) фермента измеряют числом оборотов, представляющим собой число молекул субстрата, с которым успевает прореагировать одна молекула фермента за одну секунду с последующим высвобождением продукта реакции. Многим ферментам для их функционирования требуется кофактор (см. ниже)-ион или малая молекула небелковой природы, - который связывается с белковой молекулой, образуя совместно каталитически активный комплекс. Если концентрация кофактора в клетке не является избыточной, активность фермента можно регулировать, изменяя концентрацию кофактора. Другие ферменты, напротив, не проявляют каталитической активности, пока не диссоциирует связанная с ними молекула ингибитора.
59

58 :: 59 :: Содержание
