
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

24 :: 25 :: 26 :: Содержание
2.3.3. Вода как растворитель
Алхимики средневековья, которые искали универсальный растворитель, так и не смогли найти растворителя более эффективного и более "универсального", чем вода. Этой своей способности вода в значительной степени обязана тому, что она обладает большой диэлектрической проницаемостью1, которая служит выражением электростатической полярности ее молекул. Наиболее убедительно это демонстрируют ионные соединения, или электролиты, которые могут представлять собой соли, кислоты и основания и которые обладают способностью диссоциировать на ионы при растворении в воде. (Вещества, которые при растворении не диссоциируют на ионы и, следовательно, не увеличивают проводимости раствора, называются неэлектролитами. Типичными представителями неэлектролитов являются сахара, спирты и масла.) На рис. 2-12 показана упаковка ионов Na+ и Сl- в кристалле хлористого
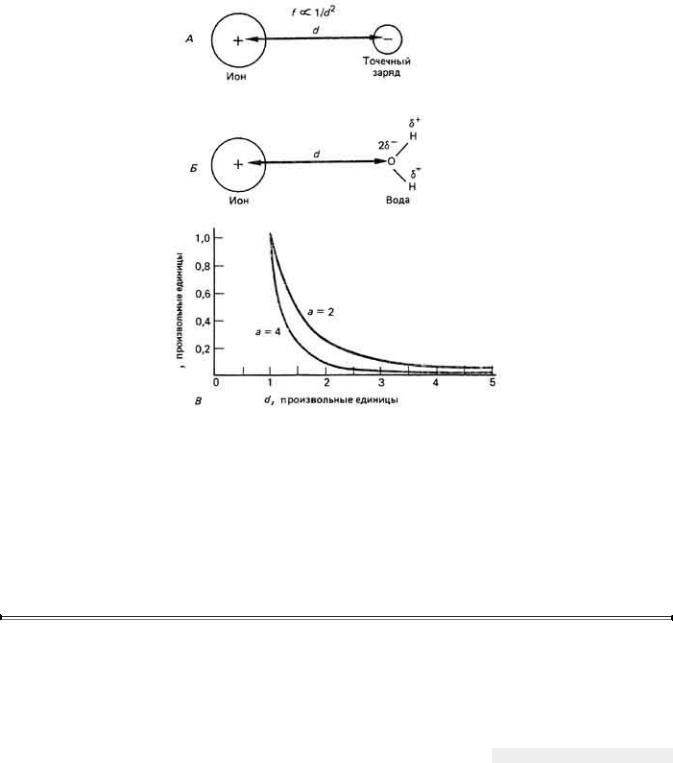
где f - сила (в динах) взаимодействия двух электрических зарядов q1 и q2 (в единицах СГСЭ), d- расстояние (в сантиметрах) между этими зарядами, ε- диэлектрическая проницаемость.
24
Рис. 2.13. Гидратация соли в воде. Атомы кислорода
в молекулах воды притягиваются к катионам, а атомы водорода-к анионам. (Biology Today, 1972.)
натрия. Такая высокоупорядоченная кристаллическая структура прочно удерживается силами электростатического притяжения между положительно заряженными ионами натрия и отрицательно заряженными ионами хлора. Жидкость, состоящая из неполярных молекул, например молекул гексана, не может растворить этот кристалл, потому что в неполярном растворителе нет
такого источника энергии, с помощью которого можно было бы оторвать ион от остальной части кристалла. Вода, однако, способна растворить кристалл NaCl, равно как и большинство других ионных соединений (в том числе соли, кислоты, основания), поскольку биполярные молекулы воды способны преодолеть силы электростатического взаимодействия между ионами, как это показано на рис. 2-13. Дробный отрицательный заряд на атоме кислорода обусловливает слабое электростатическое связывание последнего с положительно заряженным катионом (Na+ в данном случае), а дробный положительный заряд на атоме водорода - образование слабой электростатической связи между водородом и отрицательно заряженным анионом (СГ). Явление группирования молекул воды вокруг каждого отдельного иона или полярной молекулы называют сольватацией или гидратацией.
Молекулы воды вокруг ионов ориентируются таким образом, что их положительные полюсы направлены к анионам, а отрицательные-к катионам, что еще более ослабляет электростатическое притяжение между растворенными катионами и анионами ионного соединения. В определенном смысле молекулы Н2О действуют как изолятор. Первая оболочка из молекул воды притягивает к себе другие млекулы воды, ориентированные в противоположном направлении, которые образуют, таким образом, вторую оболочку из молекул воды; связывание здесь слабее, чем в предыдущем случае. Вторая оболочка может даже притянуть еще какие-то молекулы воды в третью оболочку. Таким образом, каждый ион может нести значительное количество гидратаиионной воды. При одном и том же заряде эффективный диаметр гидратированного иона связан обратной зависимостью с диаметром иона. Например, ионные радиусы Na+ и К+ равны соответственно 0,095 и 0,133 нм, а эффективные радиусы их гидратных оболочек составляют соответственно 0,24 и 0,17 нм. Наличие обратной зависимости в данном случае объясняется тем, что сила электростатического взаимодействия между ядром соответствующего иона и биполярной молекулой воды резко убывает с увеличением расстояния между ними (рис. 2-14). Таким образом, ион меньших размеров сильнее взаимодействует с молекулами воды, вследствие чего связывает больше таких молекул.
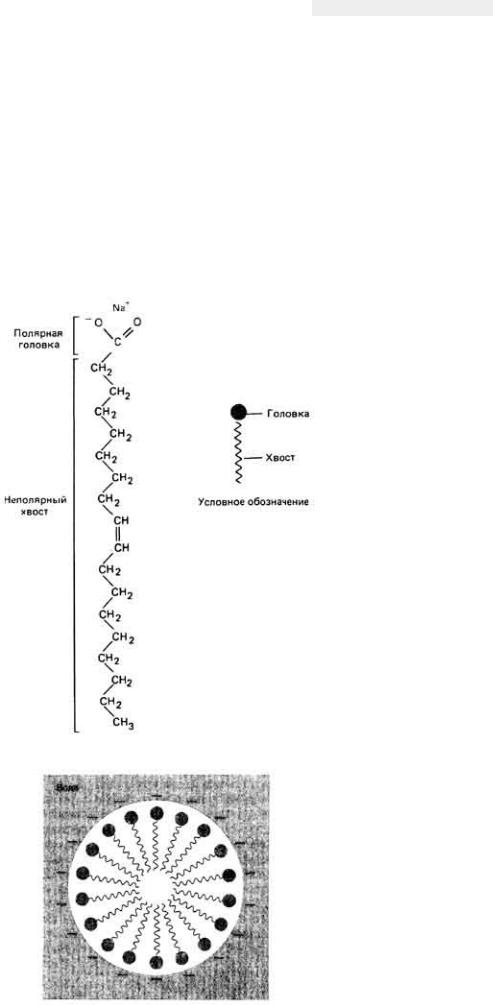
Вода растворяет также некоторые органические вещества (например, спирты и сахара), не диссоциирующие на ионы в растворе, но обладающие тем не менее свойством полярности. Напротив, абсолютно неполярные соединения типа жиров и масел вода не растворяет и не смешивается с ними, поскольку она не может образовывать с этими соединениями водородные связи. Однако вода частично реагирует с амфифильными соединениями, у которых есть и полярная, и неполярная группы. Хорошим примером может служить "мыльная" молекула (рис. 2-15), одна часть которой представляет собой гидрофильную (водолюбивую) полярную головку, а другая - гидрофобный (водоотталкивающий) неполярный "хвост". Если в воду добавить натриевую соль олеиновой кислоты и потрястд эту смесь, вода разобьет этот второй компонент на мельчайшие капли. Молекулы натриевой соли олеиновой кислоты в такой капле, или мицелле, располагаются так, как это показано на рис. 2-16: их
гидрофобные, неполярные хвостовые группы обращены к центру, а гидрофильные, полярные головки располагаются по периметру, т. е. обращены наружу, что позволяет им взаимодействовать с водой. Точно так же ведут себя молекулы фосфолипидов, которые тоже состоят из гидрофобных и гидрофильных групп. Такое свойство воды-содействовать образованию мицелл амфифильными молекулами-имеет важное значение для процесса формирования биологических мембран; оно могло лежать в основе создания первых, напоминающих клетку, структур в богатых органикой мелких морях. Как полагают, именно
25
Рис. 2.14. Зависимость от расстояния силы взаимодействия между ионом и носителем заряда. Как показано на рисунке, сила f электростатического взаимодействия между ионом и носителем заряда противоположного знака обратно пропорциональна расстоянию d между ними, возведенному в некоторую степень а. А. Для точечного заряда, или монополя, показатель степени равен 2, т.е. сила обратно пропорциональна квадрату расстояния. Б. Для диполя, например молекулы воды, величина а может достигать 4. В. Характер убывания силы электростатического взаимодействия с расстоянием для этих двух значений а. Для воды и положительного точечного заряда а ближе к 3.
в таких морях жизнь делала свои первые шаги на пути эволюционного развития.
26
1Диэлектрическая проницаемость - это величина, характеризующая уменьшение (по сравнению с вакуумом) силы электростатического взаимодействия между двумя зарядами, находящимися в данной диэлектрической среде. Сила в этом случае определяется (в системе СГСЭ) выражением
24 :: 25 :: 26 :: Содержание
26 :: 27 :: 28 :: Содержание
2.4. Растворы и их коллигативные свойства
В химии количество любого чистого вещества принято выражать в молях. Эта единица определяется как такое количество вещества, масса которого в граммах численно равна молекулярной массе вещества. Таким образом, 12 г чистого нуклида 12С-это то же самое, что 1 моль 12С или 6,022-1023 (число Авогардо) атомов углерода. И наоборот, в 2 г (т. е. 1 моль) Н2, или в 28 г (1 моль)
N2, или в 32 г (1 моль) О2 содержится 6,022-1023 молекул.
Рис. 2.15. Структурная формула полярной молекулы липидаолеата натрия-и ее условное обозначение.
Рис. 2.16. Поведение полярных липидных молекул в полярном растворителе (например, в воде). Гидрофобные концы молекулы, стремясь избежать контакта с полярным растворителем, группируются
внутри мицеллы. (Lehninger, 1975.)
26
В некоторых случаях требуется выразить количество растворенного вещества в единицах моляльности, которая представляет собой число молей вещества, растворенного в 1000 г растворителя (не раствора). Если 1 моль растворимого вещества (например, 342,3 г сахарозы) растворен в 1000 г воды, то полученный раствор будет называться одномолялънъм. Хотя 1 л воды эквивалентен по весу 1000 г, суммарный объем раствора, содержащего 1000 г воды плюс 1 моль вещества, будет несколько больше или меньше 1 л на какуюто непредсказуемую величину. Поэтому, когда речь идет о концентрации, моляльностью, как правило, не пользуются. Более удобной мерой концентрации, используемой в физиологии, служит молярностъ. Одномолярный (1 М) растворэто такой раствор, в котором 1 моль растворенного вещества вместе с растворителем дает общий конечный объем 1 л. Такая концентрация записывается как 1 моль/л, или 1 М. В лабораторных условиях 1 М раствор приготовляют, просто добавляя воду к 1 молю вещества до конечного объема 1 л. Миллимолярный раствор (мМ) содержит 1/1000 моль/л, а микромолярный (мкМ)-10-6 моль/л. Если раствор содержит эквимолярные концентрации двух компонентов, то в единице объема число молекул одного компонента равно числу молекул другого.
Суммарную концентрацию всех растворенных веществ в растворе иногда получают путем измерения коллигативных свойств раствора (измеряя, например, понижение точки замерзания). Концентрации, полученные таким образом, выражают в осмолях или миллиосмолях. Согласно теории, такое выражение концентрации эквивалентно молярности недиссоциирующего растворенного вещества, обладающего свойствами идеального газа, в растворе с аналогичными коллигативными свойствами. Число индивидуальных частиц, присутствующих в данном элементе объема раствора, при одном и том же числе растворенных молекул больше в случае электролита по сравнению с неэлектролитом из-за диссоциации молекул на ионы. Таким образом, при одинаковой молярности растворов осмолярность раствора электролита больше, чем раствора неэлектролита. Например, при растворении в воде 1 моля NaCl получается частиц почти в два раза больше, чем при растворении эквимолярного количества глюкозы, поскольку соль диссоциирует на Na + и Сl-. Из-за электростатического притяжения между катионами и анионами растворенного электролита существует статистически обусловленная вероятность того, что в любой момент времени какое-то число ионов Na+ ассоциировано с ионами С1-. Следовательно, электролит ведет себя так, как будто не все его молекулы диссоциированы. А поскольку силы электростатического взаимодействия ионов друг с другом убывают пропорционально квадрату расстояния между ними, эффективная диссоциация электролита будет тем выше, чем более он разбавлен. Таким образом, активность (т. е. эффективная концентрация свободных частиц) иона зависит от его способности к диссоциации в данном растворе, а также от его суммарной концентрации. В табл. 2-2 приведены коэффициенты активности1 некоторых распространенных электролитов. Электролиты с

высокой степенью диссоциации (т. е. обладающие большим коэффициентом активности) называются сильными электролитами (к ним относятся растворы КС1, NaCl, HC1), а электролиты, способные лишь к слабой диссоциации,-
слабыми.
Т а б л и ц а 2 - 2. Коэффициенты активности типичных электролитов при различных моляльных концентрациях (West, 1964)
Растворенные частицы независимо от их химической природы изменяют физические свойства раствора: наблюдается понижение точки замерзания, повышение точки кипения и понижение давления водяных паров. Растворенные частицы наделяют также раствор осмотическим давлением. Эти так называемые коллигативные свойства тесно связаны друг с другом и все они количественно однозначно связаны с числом частиц растворенного вещества в единице объема растворителя, т.е. с осмоляльностью. Так, 1 моль идеального компонента (т.е. такого, у которого частицы не диссоциируют и не ассоциируют), растворенного в 1000 г воды при нормальном давлении (760 мм рт. ст.), понижает точку замерзания на 1,86°С и повышает точку кипения на 0,54 °С. В идеальном приборе для определения осмотического давления (осмометре) такой раствор при стандартной температуре (0°С) покажет осмотическое давление 22,4 атм. Поскольку коллигативные свойства зависят от суммарного числа растворенных частиц, приходящегося на единицу объема растворителя, коллигативные свойства 10 мМ раствора NaCl (сильно диссоциирующий
27
электролит) и 20 мМ раствора сахарозы почти эквивалентны, так как коэффициент активности NaCl при концентрации 10 мМ равен примерно 0,9 (см. табл. 2-2)1.
28
1Коэффициент активности определяется соотношением γ = а/m, где m-моляльная концентрация, а - активность (которая представляет собой эффективную концентрацию вещества, определяемую на основе проявляемых раствором свойств).
1Значения коэффициентов активности приведены в таблице для различных моляльных, а не молярных концентраций. При низких концентрациях, однако, молярность и модальность практически совпадают.
26 :: 27 :: 28 :: Содержание
