
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

19 :: 20 :: 21 :: Содержание
2.1. Атомы, связи и молекулы
На рис. 2-3 изображена периодическая система химических элементов, из которых состоит любое вещество. В табл. 2-1 приведены основные составляющие твердой земной коры, тела человека и морской воды в порядке их распространенности в соответствующей среде. Как видно из таблицы, примерно на 99% тело человека состоит из водорода, кислорода, азота и углерода. Это характерно для любых организмов. Является ли преобладание этих элементов в живых системах просто делом случая или существует рациональное объяснение их доминирования в любом из столь большого многообразия оранизмов, возникших в процессе эволюции за прошедшие 3 млрд. лет?
Джордж Уолд, внесший большой вклад в создание химической теории зрения, утверждал, что господство в биологических системах водорода, кислорода, азота и углерода вовсе не случайно, а неизбежно вытекает из некоторых фундаментальных свойств этих элементов на уровне атомов-свойств, которые делают их особенно пригодными для создания химических основ жизни. Расмотрим кратко те факторы, которые влияют на химическое поведение атомов, а затем вернемся к тезису Уолда.
Структура атома гораздо сложнее и тоньше, чем та модель, которую мы здесь опишем; для наших целей достаточно рассмотреть самые существенные ее черты. Каждый атом представляет собой плотное ядро из протонов и нейтронов, окруженное "облаком" электронов, число которых равно числу протонов в ядре. Поскольку число отрицательно заряженных электронов равно числу положительно заряженных протонов, каждый атом в своем основном состоянии в целом электронейтрален. Электроны не занимают строго определенных орбит, но их статистическое распределение в пространстве таково, что они оказываются в некоторых точках пространства с большей вероятностью, чем в других. Такое распределение имеет вполне систематический характер, так что в атомах, содержащих один или два
Т а б л и ц а 2 - 1 . Сравнение химического состава тела человека с химическим составом морской воды и земной коры. Содержание химических элементов выражено в процентах от общего числа атомов1)

19
Рис. 2.4. Атомы водорода и гелия имеют по одной электронной
оболочке. У атома водорода она не заполнена, а у атома гелия - заполнена (два электрона).
Рис. 2.6. И у водорода, и у кислорода внешние оболочки не заполнены.
электрона (это атомы водорода и гелия), траектории электронов фактически образуют единственную "оболочку" ядра (рис. 2-4). В атомах, содержащих от трех до десяти электронов (Li, Be, В, С, N, О, F, Ne), первая оболочка заполнена двумя электронами; остальные электроны занимают вторую оболочку, внутри которой заключена первая. Вторая оболочка может содержать до восьми электронов. В атомах, имеющих более десяти протонов и соответственно десяти электронов, образуется третья оболочка, в которой может разместиться до восьми электронов, и так далее (рис. 2-5).
Когда во внешней оболочке атома находится максимально возможное для данной оболочки число электронов (2-в первой оболочке, по 8-во второй и третьей, 18-в четвертой и т.д.), т.е. когда она уже не может больше принять ни одного электрона, атом является чрезвычайно стабильным и неохотно вступает в реакции с другими атомами. Именно таковы все благородные газы (например, гелий и неон), которые расположены в крайнем правом столбце периодической таблицы. .У большинства элементов, однако, внешние электронные оболочки не
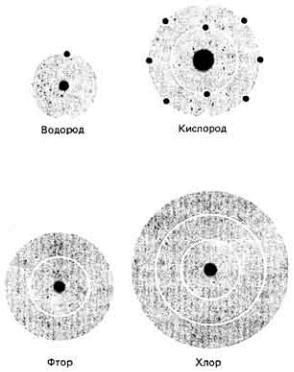
заполнены, поэтому они способны вступать в реакции с другими атомами. У водорода, например, в его единственной электронной оболочке находится только один электрон из двух возможных, а у кислорода в его внешней обол очке-только шесть электронов вместо восьми (рис. 2-6). Таким образом, оба атома - водород и кислород-стремятся к обобществлению электронов с тем, чтобы внешние их оболочки были заполнены и атомы приняли более устойчивую конфигурацию.
Число электронов во внешней оболочке во многом определяет физические свойства и реакционную способность атомов, однако на химические свойства атома заметно влияют и другие его физические характеристики. Одной из них является величина (или масса) атома. Чем тяжелее атом (т.е. чем больше протонов и нейтронов содержит ядро), тем больше электронов окружает ядро. Когда электронов становится больше десяти и образуется третья электронная оболочка, валентные электроны, т.е. электроны внешней оболочки, оказываются на
Рис. 2.5. Первые четыре электронные оболочки; показано, сколько электронов требуется для того, чтобы заполнить каждую из них.
Рис. 2.7. Внешняя электронная оболочка у атома хлора находится дальше от ядра, чем у атома фтора, поэтому электроны внешней оболочки атома хлора притягиваются к ядру с меньшей силой, чем в атоме фтора.
20
большем расстоянии от массивного ядра и поэтому притягиваются к нему с меньшей силой по сравнению с валентными электронами атомов, у которых всего две оболочки (рис. 2-7). (Напомним, что сила электростатического взаимодействия между двумя зарядами уменьшается пропорционально квадрату расстояния между ними.) Таким образом, хлор, у которого семь валентных электронов расположены в третьей оболочке, обладает меньшей реакционной способностью, чем фтор, у которого семь валентных электронов находятся во второй оболочке. Оба атома стремятся захватить один электрон, чтобы до конца заполнить внешнюю оболочку, но у фтора это стремление выражено сильнее,

поскольку его внешняя электронная оболочка испытывает более сильное электростатическое притяжение со стороны ядра, чем в большем по размерам атоме хлора. В результате при прочих равных условиях легкий атом по сравнению с тяжелым образует более прочные и, следовательно, более стабильные связи с другими атомами.
21
1)Поскольку в таблице приводятся округленные значения, соответствующие суммы не равны в точности
100. (Biology: An Appreciation of Life, 1972.)
19 :: 20 :: 21 :: Содержание

21 :: 22 :: Содержание
2.2. Свойства Н, О, N и С как основа для возникновения жизни
Теперь мы можем вернуться к утверждению Уолда, смысл которого в том, что некоторые элементы особенно существенны с точки зрения химии живых систем. Обратившись к периодической таблице (см. рис. 2-3), мы увидим, что из всех элементов, присутствующих в достаточном количестве в земной коре, лишь Н, О, N и С имеют не более двух электронных оболочек. Гелий и неон-редкие газы, практически инертные, а бор и фтор встречаются лишь в составе относительно редких солей. Металлы литий и бериллий образуют соединения с легко диссоциируемыми ионными связями. Напротив, Н, О, N и С образуют прочные ковалентные связи, обобществляя соответсвенно один, два, три и четыре электрона, которые им нужны для заполнения внешних оболочек.
Почему так важно, чтобы связи были прочными? Нетрудно представить себе, например, какой хаос воцарился бы в биологическом мире, если бы химические связи в материале, ответственном за наследственность, легко распадались. В ДНК, построенной из атомов Н, О, N, С и Р, в процессе репликации редко происходят какие-либо изменения (т. е. мутации) 1. Для эволюционного процесса случайные мутации необходимы, однако на весь краткий период существования каждого организма и каждого вида очень важно обеспечить стабильность структуры ДНК и других макромолекул, а это возможно лишь при наличии прочных связей.
Три из четырех основных биологически важных элементов (О, N, С) принадлежат к тем очень немногим элементам, которые способны образовывать двойные или тройные связи. Это значительно увеличивает набор молекулярных конфигураций, получающихся в результате реакции с этими элементами. Кислород, например, может окислить углерод до двуокиси углерода:
O=С=O
Поскольку две двойные связи полностью насыщают реакционную способность всех трех атомов этой молекулы, молекула СО 2 относительно инертна и способна поэтому диффундировать беспрепятственно из той среды, где она образовалась; затем, однако, она может вновь включаться в круговорот через процессы фотосинтеза в зеленых растениях.
Способность атомов углерода образовывать четыре простых или две двойных связи дает им богатую возможность реализовывать разнообразные комбинации атомов как из одних только атомов углерода, так и с участием других атомов. Атомы углерода могут образовывать линейные или разветвленные цепи и циклические структуры (рис. 2-8), а в сочетании с другими атомами дают практически бесконечное многообразие молекулярных
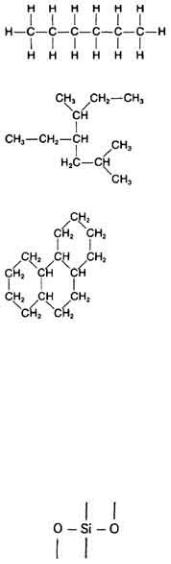
структур и конфигураций.
Кремний, который расположен в периодической таблице в том же столбце, что и углерод,
Рис. 2.8. Примеры многообразия молекулярных структур, образующихся при участии атома углерода.
21
непосредственно под ним, в некоторых своих свойствах подобен углероду. От углерода он отличается, однако, большими размерами, в силу чего неспособен образовывать двойные связи. Таким образом, он может соединиться с двумя атомами кислорода только двумя простыми связями:
При этом внешние оболочки у всех трех атомов в двуокиси кремния остаются незаполненными. Поскольку возможности образовывать связи не исчерпаны до конца, молекула двуокиси кремния охотно образует связи с себе подобными; в результате создаются громадные полимерные молекулы, из которых состоят кремнистые породы и песок. Таким образом, очевидно, что кремний, хотя и похож по ряду свойств на углерод, все же пригоден скорее для строительства булыжников, чем для широкого участия в организации биологических молекул.
Кислород помимо важной роли, заключающейся в присоединении водорода с образованием воды, служит еще конечным акцептором электронов в цепи окислительных метаболических реакций, в ходе которых высвобождается химическая энергия. Эта важная способность атома кислорода окислять другие атомы и молекулы (акцептировать их электроны) объясняется тем, что он имеет незаполненную внешнюю электронную оболочку и относительно небольшой атомный вес.

Помимо четырех главенствующих в биологии химических элементов в химических реакциях, протекающих в клетке, участвуют и другие элементы, хотя и в меньшей степени. Это, в частности, фосфор и сера, ионы четырех металлов (Na+, K+, Mg2+ и Са2+) и ион хлора (С1-). Мы, еще вернемся к ним.
22
1В среднем реже, чем один раз на 10000 актов репликаций (на 1 ген).
21 :: 22 :: Содержание
