
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

31 :: Содержание
2.5.5. Буферные системы
Из-за влияния рН на степень ионизации кислых и основных групп в белках и других биологических молекулах рН внутри- и внеклеточных жидкостей должен поддерживаться в узких пределах, в которых происходило эволюционное развитие ферментных систем. При отклонении на одну единицу рН или более нормальное функционироваю сивых систем, как правило, становится невозможным. Такая чувствительность к кислотности внутриклеточной среды отчасти объясняется тем, что скорости реакций различных ферментных систем становятся несопряженными и несогласованными. Поэтому, например, рН крови человека поддерживается с помощью естественных рН-буферов строго на уровне 7,4. Буферная система-это такая система, в которой происходит лишь незначительное изменение рН в некотором диапазоне при добавлении относительно больших количеств кислоты или основания.
Буфер должен содержать кислоту (НА), чтобы нейтрализовать добавляемые основания, и основание (А-), чтобы нейтрализовать добавляемые кислоты. (Мы уже знаем, что НА является кислотой, поскольку выступает в качестве донора Н+ , а А--основанием, поскольку выступает в качестве акцептора Н+). Таким образом, наибольшая буферная емкость такой сопряженной кислотно-основной пары имеет место тогда, когда [НА] = [А -] (естественно, они должны быть достаточно велики). Обратившись к уравнению Гендерсона-Хассельбалха, мы видим, что такая ситуация осуществляется, когда рН = рК' (поскольку lg1 = 0). Это можно видеть также на графике, где изображена кривая титрования (рис. 2- 21): эта точка принадлежит участку кривой, где изменение рН минимально.
Наиболее эффективными буферными системами являются комбинации слабых кислот с их солями. Первые диссоциируют лишь в небольшой степени, обеспечивая тем самым большой запас НА, тогда как последние диссоциируют полностью, обеспечивая большой запас А-. Поступившие в раствор ионы Н+ присоединяются, таким образом, к А- с образованием НА, а попадающие в раствор ионы ОН- объединяются с Н+ и образуют НОН. Поскольку ионы Н+ выводятся при этом из раствора, они возмещаются за счет диссоциации НА. В жидкостях организма человека и животных самыми важными неорганическими буферными системами являются бикарбонаты и фосфаты. Аминокислоты, пептиды и белки из-за наличия у них слабокислых боковых групп образуют важный класс органических буферов в цитоплазме и внеклеточной жидкости.
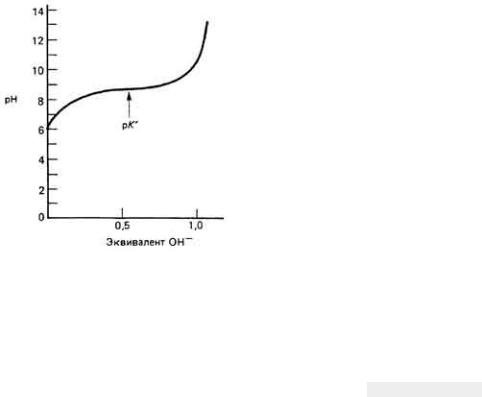
Рис. 2.21.
Сопряженная кислотно-основная система обладает наибольшей буферной емкостью, когда рН = р К' На графике эта точка соответствует участку кривой с минимальным наклоном (небольшие изменения рН при добавлении относительно больших
количеств ОН-).
31
31 :: Содержание

32 :: 33 :: 34 :: Содержание
2.6. Электрический ток в водных растворах
Вода проводит электрический ток гораздо лучше, чем масла и другие неполярные жидкости, поэтому говорят, что у нее электрическая проводимость больше, чем у неполярных жидкостей. Проводимость в водных растворах определяется как скорость переноса заряда вследствие миграции ионов под воздействием приложенной разности потенциалов. Таким образом, проводимость воды целиком зависит от присутствия в растворе заряженных атомов или молекул (ионов). Электроны, которые являются носителями электрического тока в металлах и полупроводниках, в водных растворах не принимают непосредственного участия в создании электрического тока. В чистой воде присутствуют ионы Н3О+ и ОН-. Их концентрация в этом случае
очень мала (10 -7 М при 25 °С), поэтому электрическая проводимость чистой воды, хотя и существенно выше, чем у неполярных жидкостей, все же относительно мала. Проводимость сильно возрастает после добавления электролитов, которые при растворении не остаются в виде целых молекул, а диссоциируют на катионы и анионы.
Роль ионов в проведении электрического тока иллюстрирует рис. 2-22, где изображены два электрода, погруженные в раствор хлористого калия и соединенные проводами с источником электродвижущей силы, или ЭДС, через два зажима, которые помечены соответственно + и -. Под действием ЭДС ток (представляющий собой движение положительных электрических зарядов в одном направлении) проходит через раствор электролита от одного электрода к другому.
Рис. 2,22. Прохождение тока через раствор электролита. Цветные стрелки показывают направление тока, светлые-направление движения ионов.
Т а б л и ц а 2 - 4 . Подвижность некоторых ионов в электрическом поле при 25СС, экстраполированная к условиям бесконечного разбавления
(Lehninger, 1975)

Что же такое электрический ток? В проводнике его носителем являются электроны, перемещающиеся от внешней оболочки одного атома металла к соседней, затем к следующей и т. д. В растворе КС1 электрический заряд переносится преимущественно ионами К+ и С1- (а также за счет перемещения ионов ОН-, Н3О+ и Н+, однако их вклад настолько незначителен, что им можно пренебречь). Когда к раствору электролита приложена разность потенциалов (напряжение), катионы (К+) мигрируют по направлению к катоду (электрод с отрицательным потенциалом), а анионы (С1-) - к аноду (электрод с положительным потенциалом). Скорость, с которой ион того или иного вида мигрирует в растворе, называется его подвижностью в электрическом поле. Последняя определяется массой гидратированного иона и величиной переносимого им заряда (ион может быть одно-, двухили трехвалентным). Подвижности некоторых распространенных ионов приведены в табл. 2-4. Следует помнить, что ионный ток в каком-то смысле аналогичен "эффекту домино", при котором каждая костяшка (ион) смещается лишь на небольшое расстояние, достаточное для того, чтобы подтолкнуть следующую. Однако в отличие от механического взаимодействия, как между костяшками домино, взаимодействие между ионами имеет электростатическую природу, при этом одноименные заряды взаимно отталкиваются.
За направление тока в растворе принимается направление перемещения катионов. Поток анионов движется в противоположном направлении. Скорость, с которой положительные заряды смещаются относительно какой-либо фиксированной точки в растворе, плюс скорость, с которой отрицательные заряды смещаются в противоположном направлении, определяют силу электрического тока. Ток представляет собой количество заряда, переносимого через поперечное сечение за единицу времени, и аналогичен, таким образом, объему воды, протекающему в единицу времени через поперечное сечение трубопровода (рис. 2-23, Б).
Электрический ток всегда встречает некоторое сопротивление на своем пути точно так же, как вода
32
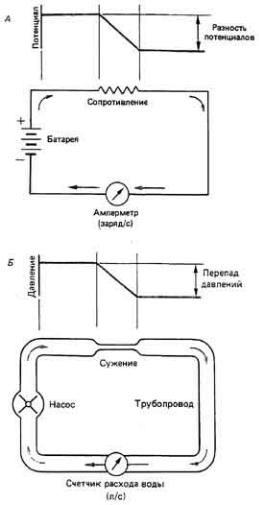
Рис. 2.23. Аналогия между током электронов в проводнике (А) и течением воды в трубопроводе (Б).
встречает механическое сопротивление при своем движении по трубопроводу, например из-за трения. Чтобы заряды могли преодолеть электрическое сопротивление, должна существовать действующая на эти заряды электростатическая сила. Такая сила (аналогичная гидростатическому давлению в водопроводной сети) появляется, если имеется перепад электрического "давления", или потенциала Е, между двумя концами участка электрической цепи, обладающего активным сопротивлением (рис. 2-23, А). Разность потенциалов, или напряжение, возникает между разделенными отрицательными ( -) и положительными ( + ) зарядами. Такая разность потенциалов, или ЭДС, связана с током I и сопротивлением R соотношением, называемым законом Ома (см. дополнение 2-1). Чтобы ток (число единиц заряда, прошедших через какоето сечение в электрической цепи в единицу времени) остался неизменным при удвоении сопротивления, требуется удвоить напряжение (рис. 2-24, А). Аналогичным образом сила тока уменьшится в два раза, если сопротивление в цепи удвоится, а напряжение останется прежним (рис. 2-24, Б).

Рис. 2.24. Иллюстрация описываемой законом Ома взаимосвязи между электрическими величинами. А. Ток остается неизменным, если одновременно удваиваются и напряжение, и сопротивление. Б. Сила тока уменьшается в два раза, если удваивается только сопротивление.
Сопротивление току в растворе определяют три основных фактора.
1. Количество носителей заряда в растворе (т. е. концентрация ионов). Чем более разбавлен раствор электролита, тем больше его сопротивление и, следовательно, тем меньше его проводимость (см. дополнение 2-1). Это легко понять, поскольку все меньше остается в растворе ионов-носителей заряда.
2 Чем меньше площадь поперечного сечения раствора в плоскости, перпендикулярной направлению тока, тем больше сопротивление, которое последнему приходится преодолевать. Здесь опять можно провести аналогию с влиянием поперечного сечения трубопровода на течение в нем воды.
3. Полное электрическое сопротивление при прохождении тока через раствор увеличивается с расстоянием. Сопротивление, преодолеваемое током на участке длиной 2 см в растворе электролита, в два раза больше сопротивления на участке длиной 1 см в том же растворе.
Ионы-носители тока - распределены равномерно по всему раствору. Ток, проходящий между двумя электродами, представлен не только прямолинейными траекториями ионов, но и искривленными, дугообразными траекториями между электродами (рис. 2-25). Это связано с тем, что в процесс вовлекается больше ионов, чем присутствует в объеме, включающем лишь прямолинейные
33

Рис. 2.25. При прохождении тока через раствор электролита ионы движутся таким образом, чтобы плотность тока была минимальна.
траектории между электродами; это уменьшает эффективное сопротивление при прохождении электрического тока.
Роль электрических явлений в физиологии животных очень велика; в этом мы убедимся, познакомившись с материалом последующих глав. Знакомство с основами электричества поможет нам также разобраться, как работают лабораторные приборы.
34
32 :: 33 :: 34 :: Содержание
