
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы
30 :: Содержание
2.5.3. Биологическая роль рН
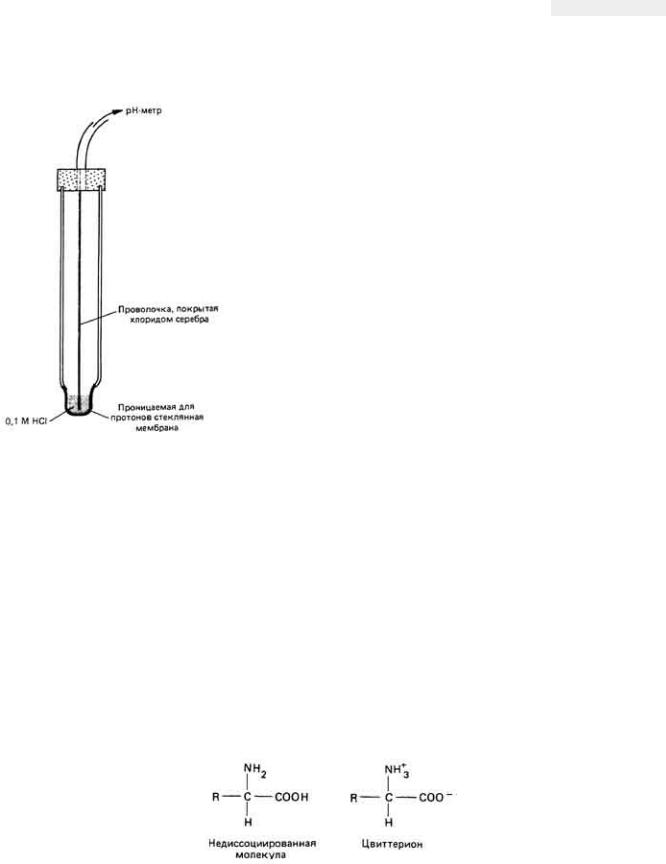
Рис. 2.20. Когда водородный электрод погружен в раствор с другой,
чем внутри электрода,
концентрацией [H+], между внутренней и наружной поверхностями электродной мембраны из Н+-проницаемого стекла устанавливается разность потенциалов,
пропорциональная логарифму отношения [H+] по разные стороны мембраны.
Концентрации водородного и гидроксильного ионов имеют важное значение для биологических систем, поскольку протоны могут свободно покидать ионы Н3О+ и присоединяться к отрицательно заряженным группам, тем самым нейтрализуя их, а гидроксильные ионы способны нейтрализовать положительно заряженные группы. Такая возможность нейтрализации особенно важна для аминокислот и белков, в которых имеются и карбоксильные (....СООН), и амино-(....NН2) группы. Аминокислоты в растворах обычно находятся в биполярной форме, которая называется цвиттерионом:
Заметим, что при определенном значении рН раствора (в так называемой газоэлектрической точке) результирующий заряд молекул аминокислоты, которые могут быть при этом как в недиссоциированной форме, так и в виде цвиттериона, равен нулю. При повышении кислотности раствора концентрация Н+ увеличится. В результате вероятность нейтрализации протоном карбоксильной группы будет больше, чем вероятность захвата гидроксильным ионом лишнего протона с аминогруппы. Значительная доля молекул этой
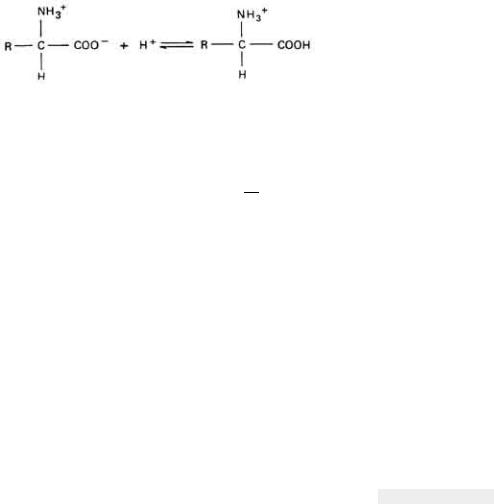
аминокислоты будет обладать, следовательно, положительным результирующим зарядом:
Повышение рН приведет, естественно, к противоположному результату. Каждый вид цвиттериона имеет свою характеристическую изоэлектри-ческую точку, т. е. такое значение рН, при котором его полный заряд (статистически усредненный) равен нулю. Ряд аминокислот не имеет никаких других амфотерных групп, кроме групп α ... СООН и α ... NН3, которые участвуют в образовании пептидных связей. Другие аминокислоты, однако, имеют дополнительные боковые карбоксильные или аминогруппы, которые могут проявлять кислотные или основные свойства. Диссоциирующие боковые группы в макромолекуле определяют в значительной мере ее электрические свойства и обусловливают ее чувствительность к рН среды. Эта чувствительность наиболее ярко проявляется в изменении свойств активного центра фермента. Связывание субстрата активным центром фермента обычно включает электростатические взаимодействия, поэтому образование фермент-субстратного комплекса является в высшей степени рН-зависимым процессом, и существует оптимальный рН, при котором вероятность его образования максимальна.
30
30 :: Содержание

30 :: 31 :: Содержание
2.5.4. Уравнение Гендерсона-Хассельбалха
Некоторые кислоты (например, НС1) диссоциируют полностью, тогда как другие (например, уксусная кислота)-лишь частично. Записав в общем виде реакцию диссоциации кислоты
получим, согласно закону действующих масс, следующее выражение для константы диссоциации:
30
Удобно пользоваться логарифмическим представлением К', аналогичным рН,
т.е. рК':
Соответственно запись рК' = 11 означает, что К' = 10-11. Низкое значение рК' отвечает сильной кислоте, высокое значение-слабой.
Задачи, связанные с кислотностью-основностью, можно представить в более простом виде, если преобразовать равенство (2-2). Прологарифмировав обе части, получим
После перестановки имеем
Заменив -lg[H+] на рН и -IgK' на рК', получим
Таким образом,
Это - уравнение Гвндерсона-Хасселъбалха, которое позволяет рассчитать рН

сопряженной кислотно-основной пары, если известны рК' и молярное отношение для этой пары. И наоборот, оно позволяет вычислить рК' если известен рН раствора с известным молярным отношением.
31
30 :: 31 :: Содержание
