
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы

53 :: 54 :: 55 :: Содержание
3.2. Перенос химической энергии в системе сопряженных реакций
Существует несколько типов биохимических реакций, но такие их характеристики, как скорость и кинетика, можно рассмотреть на примере простой реакции обмена, в которой молекулы двух исходных веществ, А и В, реагируют друг с другом с образованием двух новых молекул - продуктов С и D:
Стрелки показывают, что эта реакция обратима. Вообще говоря, обратимой, т.е. идущей в обоих направлениях, является любая химическая реакция при условии, что ее продукты остаются в растворе. У некоторых реакций, однако, тенденция идти в прямом направлении настолько сильнее обратной тенденции, что их можно считать практически необратимыми. Реакция идет преимущественно в прямом направлении, если при этом происходит высвобождение химической энергии (т.е. если продукты реакции обладают меньшей свободной энергией, чем исходные реагирующие вещества) и, таким образом, изменение свободной энергии в этой реакции отрицательно. В данном случае исходные вещества обладают большей потенциальной энергией, чем продукты реакции (рис. 3-4,A); такие реакции называются экзоэргическими или экзотермическими. Они обычно протекают с выделением тепла. Примером может служить реакция окисления водорода:
Эта реакция может идти в обратном направлении в процессе фотосинтеза за счет использования энергии квантов света, уловленных хлорофиллом:
Данная реакция, требующая притока энергии извне, служит примером
эндоэргической или эндотермической, реакции, идущей "в гору" (рис. 3-4,Б).
Количество энергии, выделяемой или поглощаемой в реакции, непосредственно связано с константой равновесия K'eq этой реакции. Она представляет собой отношение двух величин - величины, зависящей от концентраций продуктов реакции, к величине, зависящей от концентраций исходных реагирующих веществ, - после достижения равновесия, т.е. состояния, когда скорости прямой и обратной реакций становятся одинаковыми и, следовательно, концентрации исходных реагирующих веществ и продуктов больше не "меняются. Для реакции типа (3-2)

где [А] и [В], [С] и [D] - равновесные молярные концентрации соответственно исходных реагирующих веществ и продуктов реакции. Очевидно, что чем сильнее тенденция к протеканию реакции в прямом направлении, т. е. к сдвигу равновесия вправо, тем больше величина K'eq. Эта тенденция зависит от
Рис. 3.4. А. Экзоэргическая (идущая "под гору") реакция-это такая реакция, в которой образующиеся продукты обладают меньшей потенциальной энергией по сравнению с исходными реагирующими веществами. Б.
Эндоэргическая (идущая "в гору") реакция требует поступления энергии извне, так как в продуктах реакции заключена большая потенциальная энергия, чем в исходных реагентах. (Baker, Allen, 1965.)
53
разности G свободных энергий продуктов реакции С и D, с одной стороны, и исходных реагирующих веществ А и В - с другой. Чем больше эта разность, тем сильнее сдвинуто равновесие вправо и тем больше K'eq. Константа равновесия связана с приростом стандартной свободной энергии G° химической системы соотношением
Из равенства (3-4) следует, что если K'eq > 1, то ΔG° < 0, а если K'eq < 1, то ΔG° > 0. Экзоэргические реакции сопровождаются убыванием свободной энергии, т. е. для них ΔG° < 0. Следовательно, они протекают самопроизвольно, не нуждаясь в энергии извне. Эндоэргические реакции характеризуются положительным значением G°, т.е. требуют притока энергии - самопроизвольно реакция не пойдет. Одни биохимические процессы в живых клетках являются экзоэргическими, другие - эндоэргическими. Экзоэргические процессы, протекая самопроизвольно в соответствующих условиях, не
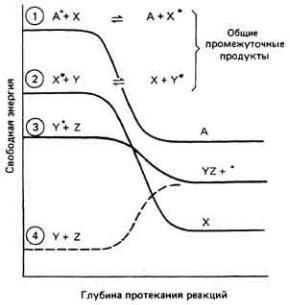
представляют особых проблем с точки зрения энергетики. Эндоэргические же процессы, напротив, необходимо "подталкивать". В клетке это обычно осуществляется с помощью сопряженных реакций, в которых для передачи химической энергии от молекулы с относительно высоким ее содержанием к реагенту с более низким содержанием энергии используется общий промежуточный продукт. В результате исходный реагент превращается в более высокоэнергетическое соединение, которое может "подтолкнуть" реакцию, затратив часть энергии. Этот принцип иллюстрирует рис. 3-5, где А, X, Y и Z - гипотетические соединения. Звездочка у символа А означает, что данное соединение содержит высокоэнергетическую группу. Эта группа переносится с некоторой потерей свободной энергии на X в реакции 1. В результате X превращается в высокоэнергетический промежуточный продукт X*. Как показано на рисунке, данная реакция, как и реакции 2 и 3,-экзоэргическая. В реакции 2 высокоэнергетическая группа переносится с X* не реагент Y, при этом также теряется некоторая часть свободной энергии. Имея такую высокоэнергетическую группу, реагент Y, (теперь уже Y*) может самопроизвольно реагировать с Z с образованием соединения YZ, свободная энергия которого выше, чем суммарная свободная энергия исходных компонентов Y и Z, но ниже, чем Y* + Z. Таким образом, химическая энергия, заключенная в молекуле А*, через посредство
Рис. 3.5. Сопряженные реакции. 1. Высокоэнергетическая молекула А* передает энергию соединению X с образованием промежуточного продукта X*. 2. Последний в свою очередь реагирует экзоэргически с Y, образуя промежуточный продукт У* (3), который далее реагирует экзоэргически с Z. 4. Реакция Y+ Z, будучи эндоэргической, не могла бы осуществиться без передачи химической энергии от X* к Y.
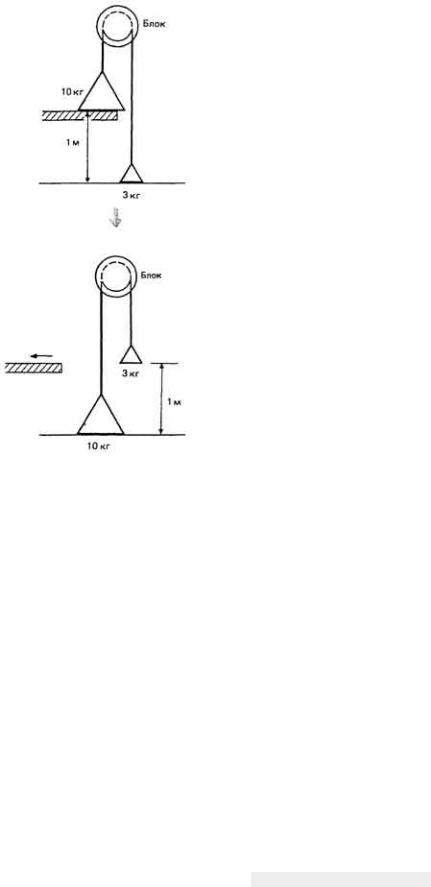
Рис. 3.6. Механический аналог сопряженной реакции: энергия, которую необходимо затратить на подъем груза массой 3 кг, обеспечивается за счет падения другого груза массой 10 кг.
54
общих промежуточных продуктов X* и Y* используется для синтеза YZ из Y и Z (реакция 4).
На рис. 3-6 изображен механический аналог сопряженной реакции. Потенциальная энергия левого груза массой 10 кг, который опускается вниз с высоты 1 м, уменьшается на 10 м·кг, при этом правый груз массой 3 кг, потенциальная энергия которого вначале была равна 0, поднимается на ту же высоту 1 м. Очевидно, что груз, который опускается под действием собственного веса, может поднять другой груз только тогда, когда его масса больше, чем у поднимаемого груза. Аналогичным образом экзоэргическая реакция может "подтолкнуть" эндоэргическую лишь в том случае, если первая высвобождает больше химической энергии, чем требуется второй. Вследствие этого какая-то часть энергии теряется и КПД передачи всегда меньше 100%.
55
53 :: 54 :: 55 :: Содержание
