
- •Содержание
- •От редактора перевода
- •Предисловие
- •Благодарности
- •1.1. Для чего нужна физиология животных
- •1.2. Физиология и медицина
- •1.3. Физиология и познание
- •1.4.1. В основе любой функции лежит структура
- •1.4.2. Генетика и физиология
- •1.4.3. Принцип гомеостаза
- •1.5. Физиологическая литература
- •1.6. Резюме
- •1.7. Вопросы для повторения
- •Литература
- •Глава 2. Физические и химические концепции
- •2.1. Атомы, связи и молекулы
- •2.3.1. Молекула воды
- •2.3.2. Свойства воды
- •2.3.3. Вода как растворитель
- •2.4. Растворы и их коллигативные свойства
- •2.5.1. Ионизация воды
- •2.5.2. Кислоты и основания
- •2.5.3. Биологическая роль рН
- •2.5.4. Уравнение Гендерсона-Хассельбалха
- •2.5.5. Буферные системы
- •2.6. Электрический ток в водных растворах
- •2.7. Ионная избирательность
- •2.8.1. Липиды
- •2.8.2. Углеводы
- •2.8.3. Белки
- •2.8.4. Нуклеиновые кислоты
- •2.9. Резюме
- •2.10. Вопросы для повторения
- •Глава 3. Ферменты и энергетика
- •3.1. Энергия: понятия и определения
- •3.2. Перенос химической энергии в системе сопряженных реакций
- •3.3. АТР и высокоэнергетическая фосфатная группа
- •3.4. Температура и скорость реакции
- •3.5. Ферменты
- •3.5.1. Специфичность фермента
- •3.5.2. Каталитическая активность
- •3.5.3. Температура и скорость реакции
- •3.5.4. Чувствительность к рН
- •3.5.5. Регуляция ферментативной активности
- •3.5.6. Кофакторы
59 :: 60 :: Содержание
3.5.1. Специфичность фермента
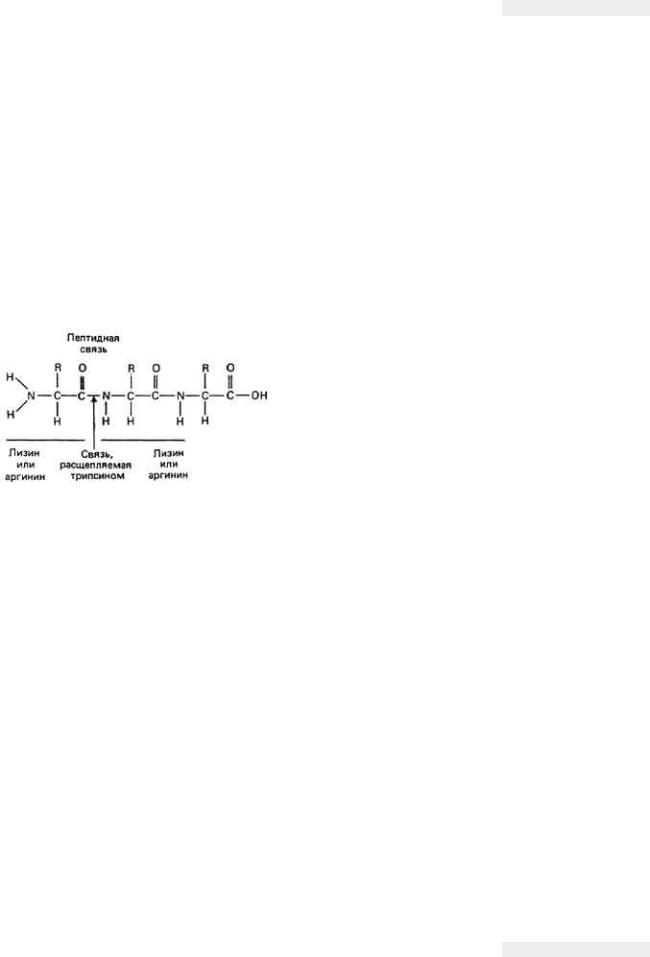
Каждый фермент в той или иной степени специфичен к какому-то определенному субстрату (молекуле реагента). Некоторые ферменты обладают повышенным сродством к определенному типу связей и могут, таким образом, взаимодействовать с молекулами самых разных субстратов, у которых есть такие связи. Например, реакция, катализируемая протеолитическими ферментами, представляет собой гидролиз пептидных связей. Протеолитический фермент трипсин, обнаруженный в пищеварительном тракте, катализирует реакцию гидролиза
59
Рис. 3.14. Специфичность фермента трипсина, который
избирательно гидролизует связь C-N внутри пептидной связи, соединяющей два остатка лизина, или два остатка аргинина, или остатки лизина и аргинина. (Baker, Allen, 1965.)
любой пептидной связи, карбонильная группа которой принадлежит остатку аргинина или лизина, независимо от того, где расположены эти связи в полипептидной цепи (рис. 3-14). Другой присутствующий в кишечнике протеолитический фермент - карбокси-пептидаза - катализирует исключительно гидролиз пептидной связи, соединяющей последний и предпоследний аминокислотные остатки в полипептидной цепи. Большинство ферментов проявляет гораздо большую специфичность по отношению к своим субстратам. Например, фермент сахараза катализирует только гидролиз сахарозы с образованием глюкозы и фруктозы. Другие дисахариды, например лактоза или мальтоза, не являются субстратом для этого фермента, но гидролизуются другими ферментами, которые к ним специфичны (лактазой и мальтазой в приведенном выше примере). Многие ферменты способны различать оптические изомеры-молекулы, идентичные по химическому составу и структуре и являющиеся зеркальным отражением одна другой. Например, фермент L-аминооксидаза катализирует окисление L-изоме-ра а-кетокислоты, но совершенно неспособен катализировать превращение D-изомера.
60
59 :: 60 :: Содержание

60 :: Содержание
3.5.2. Каталитическая активность
Упомянутая структурная специфичность фермента отражает тот факт, что молекула субстрата должна соответствовать, как ключ замку, особому участку в структуре фермента, называемому активным центром. Молекула фермента состоит из одной или нескольких полипептидных цепей, свернутых в третичную структуру таким образом, что сформировавшаяся белковая частица имеет более или менее глобулярный характер и специфическую конформацию. Считается, что активный центр образован боковыми группами нескольких аминокислотных остатков, которые на уровне третичной структуры формируют участок, к которому присоединяются молекулы субстрата, обладающие избирательным сродством к данному активному центру. В связывании участвуют ионные взаимодействия, вандерваальсовы силы и водородные связи. Значительная часть аминокислотных остатков, локализованных в области активного центра, имеет ионогенные боковые группы, экспонированные наружу. Они могут способствовать связыванию субстрата (субстратов) и кофактора (кофакторов) или участвовать непосредственно в самой реакции.
Идея о стереоспецифичности активного центра получила достаточно убедительное подтверждение в опытах по определению реакционной способности химически модифицированных молекул субстрата (т.е. молекул, лишь незначительно отличающихся от молекул субстрата). Эффективность связывания становится тем меньше, чем больше модифицированные молекулы отклоняются от оптимального варианта по таким параметрам, как межатомные расстояния, число и положение заряженных групп и валентные углы.
Вопрос о механизмах ферментативного катализа, т.е. вопрос о том, каким образом ферментам удается ускорить реакцию, относится в конечном счете к области органической химии. Ленинджер (1975) перечисляет четыре основных механизма, каждый из которых, как полагают, может внести свой вклад в то огромное ускорение реакций, которое достигается при участии ферментов.
1.Некоторые ферменты могут фиксировать молекулы реагентов таким образом, что реагирующие группы оказываются на достаточно близком расстоянии друг от друга при соответствующей ориентации, что сильно увеличивает вероятность реакции.
2.Фермент может прореагировать с молекулой субстрата с образованием нестабильного промежуточного соединения, которое далее охотно вступает в другую реакцию, в результате которой образуются конечные продукты.
3.Боковые группы в области активного центра могут выступать в качестве доноров или акцепторов протонов, создавая условия для протекания общекислотных или общеосновных реакций.
4.Связывание фермента с субстратом может привести к внутреннему напряжению в соответствующей связи, что увеличивает вероятность ее разрыва.

Так или иначе, образование фермент-субстратного комплекса (ES)
увеличивает вероятность реакции. По завершении реакции фермент и продукты реакции отделяются друг от друга, и молекула фермента вновь может образовать комплекс с новой молекулой субстрата. Поскольку ES существует в течение какого-то конечного промежутка времени, может оказаться, что все молекулы фермента будут связаны в ES, если концентрация субстрата достаточно велика.
60
60 :: Содержание

61 :: Содержание
3.5.3. Температура и скорость реакции
Любой фактор, влияющий на конформацию белковой молекулы и, следовательно, на расположение аминокислотных боковых групп в активном центре, будет влиять и на активность фермента. Один из таких факторов - температура. При повышении температуры увеличивается вероятность денатурации -разрушения третичной структуры полипептидных цепей, что приводит к появлению все возрастающего числа инактивированных молекул фермента. Этим объясняется характерная зависимость скорости реакции от температуры в реакциях, катализируемых ферментами (рис. 3-15). По мере повышения температуры скорость реакции сначала растет благодаря возрастанию кинетической энергии молекул субстрата. При дальнейшем повышении температуры возрастает и скорость инактивации фермента из-за развертывания полипептидных цепей белка в силу ослабления водородных и других связей. При некоторой температуре (оптимальной температуре) скорость тепловой денатурации фермента в точности уравновешивается возрастанием реакционной способности в системе фермент-субстрат, и оба этих эффекта компенсируются, а скорость реакции достигает максимума. При более высоких температурах денатурация фермента становится преобладающим процессом, и скорость реакции быстро падает. Температурная чувствительность ферментов и других белковых молекул является одной из причин летального действия повышенных температур.
61
61 :: Содержание
