
andruhova
.pdf
(30%)—средними, менее 0,03 (3%)—слабыми электролитами. Так, для
0,1Н раствора CH3COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы.
Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация НСl выразится
уравнением: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
H+ + Cl– . |
|
|
|
|
|||||||||
|
|
|
|||||||||
Основания диссоциируют с образованием катионов металла и |
|||||||||||
гидроксид-ионов. Например, диссоциация КОН выразится уравнением |
|||||||||||
|
|
|
|
|
|
КОН |
|
|
К+ + ОН–. |
||
|
|
|
|||||||||
|
|
|
|||||||||
Многоосновные слабые кислоты диссоциируют ступенчато: |
|||||||||||
H3PO4 |
|
|
|
|
H+ + H2PO4– |
(первая ступень) |
|||||
|
|
|
|||||||||
|
|
|
|||||||||
H2PO4– |
|
|
|
|
|
H+ + HPO42– |
(вторая ступень) |
||||
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||
HPO42– |
|
|
|
|
|
H+ + PO43– |
(третья ступень). |
||||
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||
Средние соли, растворимые в |
воде, |
диссоциируют с образованием |
|||||||||
положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка:
Ca(NO3)2 |
|
|
Ca2+ + 2NO3– |
|
|
|
|||
|
|
|||
Al2(SO4)3 |
|
|
2Al3+ +3SO42–. |
|
|
||||
|
|
|
||
Кислые соли – электролиты, |
содержащие в анионе водород, |
|||
способный отщепляться в виде иона Н+. Кислые соли рассматривают как
продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Диссоциация кислых солей происходит по ступеням, например
KHCO3 |
|
|
K+ + HCO3– |
(первая ступень) |
|
|
|
||||
|
|
||||
HCO3– |
|
|
H+ + CO32– |
(вторая ступень). |
|
|
|
||||
|
|
||||
81

Однако степень электролитической диссоциации по второй ступени очень мала, поэтому раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли – электролиты, содержащие в катионе одну или несколько гидроксогрупп OH–. Основные соли характерны для многовалентных металлов. Их рассматривают как продукт неполного замещения гидроксогрупп основания на кислотные остатки. Основные соли диссоциируют с образованием основных и кислотных остатков.
FeOHCl2 |
|
|
|
FeOH2+ + 2Cl– |
|
|
|||
|
|
|||
(ZnOH)2SO4 |
|
|
|
2ZnOH+ + SO42–. |
|
|
|
||
|
|
|
Двойные соли состоят из ионов двух разных металлов и кислотного остатка
KAl(SO4)2 
 = K+ + Al3+ + 2SO42─
= K+ + Al3+ + 2SO42─
В состав комплексных солей входят сложные (комплексные) ионы (квадратные скобки)
K4[Fe(CN)6] |
|
|
|
4K+ + [Fe(CN)6]4─ |
|
|
|||
|
|
|||
[Ag(NH3)2]Cl |
|
|
|
[Ag(NH3)2]+ + Cl─ |
|
|
|
||
|
|
|
Комплексные ионы в очень малой степени диссоциируют на ионы.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые.
Сильные электролиты диссоциируют практически полностью (α =1).
Ксильным электролитам относятся:
1)Кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);
2)Щелочи (гидроксиды металлов первой группы главной подгруппы
–LiOH, NaOH, KOH, RbOH, CsOH) и Ba(OH)2;.
3)Соли, растворимые в воде (см. табл. растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии
82
(в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся
1)Неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS, HСlO и др.);
2)вода (H2O);
3)многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH;
4)большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH);
5)плохо растворимые соли (см. табл. растворимости).
6.3.2.Обменные реакции в растворах электролитов
Вобменных реакциях, протекающих в растворах электролитов, наряду
снедиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы.
Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений.
Запишем реакцию обмена сильных электролитов в молекулярной
форме:
NaCl + KNO3 = NaNO3 + KCl
Так как все участвующие в реакции электролиты являются сильными
(растворимые соли), то полное ионно-молекулярное уравнение будет
иметь следующий вид:
Na++Cl─+K++NO3─ = Na++NO3─+K++Cl ─
С точки зрения теории электролитической диссоциации в данном случае реакция не происходит.
83
При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты:
HClO4 + NaOH =NaClO4 + H2O
2HNO3 + Ba(OH)2 = Ba(NO3)2 + 2H2O.
Это говорит о том, что подобные реакции сводятся к одному процессу.
Перепишем первое уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые
– в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул:
H+ + ClO4 + Na+ + OH = Na+ + ClO4 + H2O
Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции и получим краткое ионно-молекулярное уравнение:
H+ + OH– = H2O.
Для второй реакции краткое ионно-молекулярное уравнение выражается таким же уравнением. Из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды.
Аналогично уравнения реакций:
BaCl2 +H2SO4 = BaSO4 ↓+ 2HCl,
Ba(NO3)2 + Na2SO4 = BaSO4 ↓+ 2NaNO3
выражают один и тот же процесс образования из ионов Ва2+ и SO42— осадка малорастворимого электролита – сульфата бария
Ва2+ + SO42– = BaSO4↓.
84
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону
образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей
CH3COONa + HCl = CH3COOH + NaCl.
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов:
CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl–
или в сокращенном виде:
CH3COO– + H+ = CH3COOH.
Аналогично протекают реакции между сильными основаниями и солями слабых оснований. Например
FeSO4 + 2 NaOH = Na2SO4 + Fe(OH)2↓
Fe2+ + SO42– + 2 Na+ + 2 OH– = SO42– + 2 Na+ + Fe(OH)2↓
Fe2+ + 2 OH– = Fe(OH)2↓.
Таким образом, реакции идут до конца, если в результате
взаимодействия веществ происходит образование осадка, выделение газа и образование слабого электролита.
При написании ионно-молекулярных уравнений реакций, слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а находящиеся в растворе сильные электролиты – в виде составляющих их ионов.
Все рассмотренные уравнения реакций являются необратимыми т.к. равновесие в них смещено вправо вследствие малой растворимости BaSO4 и Fe(OH)2, образовании уксусной кислоты и воды.
85

Однако в обменные реакции могут вступать растворы сильных и слабых электролитов, что может приводить к образованию слабых электролитов. Такие реакции являются обратимыми. Например
FeS + 2HCl 
 FeCl2 + H2S.
FeCl2 + H2S.
Запишем его в ионно-молекулярной форме, оставив в виде молекул нерастворимый сульфид железа (FeS) и слабодиссоциируемый газообразный сероводород (H2S). Сильные электролиты (HCl и FeCl2) запишем в виде
ионов. |
|
FeS + 2 H+ + 2Cl- |
Fe2+ +2Cl- + H2S. |
Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях уравнения, получаем сокращенное ионно-молекулярное уравнение:
FeS + 2 H+ 
 Fe2+ + H2S.
Fe2+ + H2S.
6.3.3. Водородный показатель
Чистая вода обладает незначительной электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы:
H2O 
 H+ + OH–
H+ + OH–
Такой процесс называется автопротолизом (самодиссоциацией). По величине электропроводности чистой воды можно вычислить концентрации ионов H+ и OH–. При 25°С они равны по 10–7 моль/л.
Выражение для константы диссоциации воды имеет вид:
K = |
[H+ ][OH − ] |
, |
||
[H2O] |
|
|||
|
|
|||
откуда [H+][OH–] = K[H2O]=Kw .
86
В воде и разбавленных водных растворах концентрацию воды можно считать постоянной: [H2O]=55,5 моль/л, поэтому Kw – константа. Выражение, полученное для Kw, показывает, что в воде и разбавленных водных растворах при постоянной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Она называется ионным произведением воды. При 25°С Kw=10–14.
В кислых растворах больше концентрация ионов водорода, в
щелочных – концентрация ионов OH–. Однако произведение этих концентраций всегда остается постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода повысилась до 10–3 моль/л, то концентрация гидроксид-ионов станет равной 10–11 моль/л. Следовательно, если известна величина [H+], то однозначно определяется величина [OH–]. Поэтому степень кислотности или щелочности раствора
можно количественно охарактеризовать концентрацией ионов водорода:
Нейтральный раствор [H+]=10–7 моль/л;
кислый раствор |
[H+]>10–7 |
моль/л; |
щелочной раствор |
[H+]<10–7 |
моль/л. |
Наиболее часто используют не концентрацию [H+], а ее десятичный логарифм, взятый с обратным знаком:
pH= –lg [H+].
Эта величина называется водородным показателем.
Например, если [H+]=10–5 моль/л, то pH=5; если [H+]=10–9 моль/л, то pH=9. Отсюда следует, что в нейтральном растворе pH=7, в кислом растворе pH<7, в щелочном растворе pH>7. Иногда пользуются значением pOH= – lg[OH–]. При 25°С выполняется равенство: pH+pOH=14.
Для многих процессов величина pH очень важна (для жизнедеятельности растений и животных – pH крови, почвенного раствора). Свойства природных вод, в частности их коррозионная активность, сильно зависят от pH.
87
6.4. Гидролиз солей
Опыт показывает, что растворы средних солей имеют щелочную, кислую или нейтральную реакции, хотя они не содержат ни водородных, ни гидроксильных ионов. Объяснение этому факту следует искать во взаимодействии солей с водой.
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением рН среды.
Суть гидролиза солей заключается в том, что происходит смещение
равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта.
В результате гидролиза могут образовываться молекулы слабых кислот и оснований, анионы кислых солей или катионы основных солей. В большинстве случаев гидролиз является обратимым процессом. При повышении температуры и разбавлении гидролиз усиливается. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Гидролиз идет только по слабому иону: аниону слабой кислоты и
катиону слабого основания.
Рассмотрим различные случаи гидролиза солей.
I) Соли, образованные сильной кислотой и сильным основанием
(NaCl, K2SO4, RbBr и др.) гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O (рН=7). Ионы таких солей не могут образовывать с водой слабых электролитов.
II) Гидролиз соли, образованной сильным основанием и слабой кислотой протекает по аниону слабой кислоты. Избыток ионов OH– в растворе обуславливает щелочную реакцию среды в растворе (pН>7).
88
Рассмотрим гидролиз соли K2S. При растворении K2S в воде диссоциирует:
K2S 
 2K+ +S2-.
2K+ +S2-.
При составлении уравнений гидролиза в первую очередь необходимо определить ионы соли, связывающие ионы воды в малодиссоциирующие соединения, т.е. ионы, обусловливающие гидролиз. В данном случае ионы слабой кислоты S2- связывают катион H+, образуя ион HS–:
S2– +H2O 
 HS– +OH–
HS– +OH–
Уравнение гидролиза в молекулярной форме будет иметь следующий вид:
K2S+H2O 
 KHS+KOH.
KHS+KOH.
Практически гидролиз соли ограничивается первой ступенью с образованием кислой соли (в данном случае KHS). До образования слабой кислоты гидролиз подобных солей не доходит из-за накопления в растворе ионов ОН-.
III) Гидролиз соли, образованной слабым основанием и сильной кислотой (CuCl2, Al2(SO4)3) протекает по катиону соли. Избыток ионов H+ в растворе обуславливает кислую реакцию среды в растворе (рН<7).
При растворении в воде CuCl2 диссоциирует: СuCl2 
 Cu2+ +2Cl–
Cu2+ +2Cl–
В данном случае ионы Cu2+ соединяются с ионами OH–, образуя гидроксоионы CuOH+. Гидролиз соли ограничивается первой ступенью, и
образование молекулы Cu(OH)2 не происходит. Ионно-молекулярное уравнение гидролиза имеет следующий вид:
Cu2+ + HOH 
 CuOH++ H+.
CuOH++ H+.
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом:
CuCl2+H2O 
 CuOHCl+ HСl.
CuOHCl+ HСl.
При растворении в воде Al2(SO4)3 диссоциирует на ионы :
89
Al2(SO4)3 
 Al3+ + 3SO42-.
Al3+ + 3SO42-.
В данном случае ионы Al3+ соединяются с ионами ОН-, образуя гидроксоионы AlOH2+. Гидролиз соли ограничивается первой ступенью, и
образование молекулы Al(OH)3 не происходит. Ионно-молекулярное уравнение имеет вид:
Al3+ + Н2О 
 AlOH2++ Н+.
AlOH2++ Н+.
Продуктами электролиза является основная соль и кислота.
Уравнение гидролиза в молекулярной форме записывается следующим образом:
Al2(SO4)3 + 2Н2О 
 2AlOHSO4 + H2SO4.
2AlOHSO4 + H2SO4.
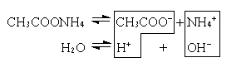
IV) Cоль, образованная слабой кислотой и слабым основанием (CH3COONH4), гидролизуется по катиону и аниону, их ионы одновременно связывают ионы Н+ и OH–. Гидролиз идет глубоко. В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
CH3COO– + NH4+ + H2O 
 CH3COOH + NH4OH.
CH3COOH + NH4OH.
Если продукты гидролиза могут удаляться из раствора, то гидролиз протекает до конца. Например
Al2S3 + 3 H2O 
 Al(OH)3↓ + H2S↑
Al(OH)3↓ + H2S↑
Взаимное усиление гидролиза. Допустим, что в разных сосудах установились равновесия:
CO32– + H2O 
 HCO3– + OH–
HCO3– + OH–
Al3+ + H2O 
 AlOH2+ + H+.
AlOH2+ + H+.
90
