
andruhova
.pdf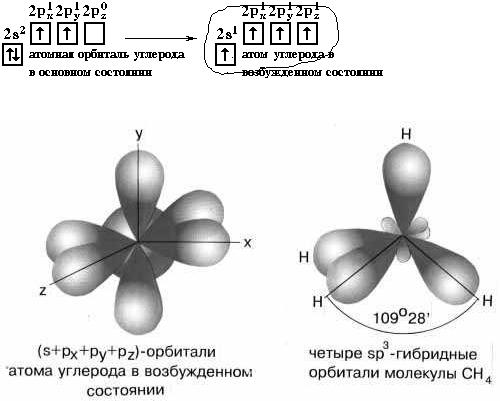
нормальном состоянии имеет только два неспаренных р-электрона, при переходе в возбужденное состояние электронная конфигурация имеет вид 2s12р3. Каждая из четырех sp3 –гибридных орбиталей атома углерода перекрывается с s - электроном атома водорода, образуя четыре равноценные ковалентные связи С —Н.
Рисунок 8.4. – Перекрывание sp3-орбиталей атома углерода и s-орбиталей атома водорода в молекуле СН4
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90°, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу.
141
|
Таблица 8.1. |
Гибридизация и |
пространственная |
конфигурация |
||
молекул и ионов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Тип |
молекулы |
Валентные орбитали |
Пространственная |
|
Примеры |
|
или иона |
центрального атома |
конфигурация |
|
|
||
|
|
|
|
|
|
|
|
AB2 |
|
p2 (чистые) |
угловая |
|
H2S |
|
|
|
sp (гибридные) |
линейная |
|
BeCl2 |
|
|
|
|
|
|
|
|
AB3 |
|
p3 (чистые) |
пирамида |
|
PH3 |
|
|
|
sp2 (гибридные) |
треугольник |
|
BF3 |
|
|
|
|
|
|
|
|
AB4 |
|
sp3 (гибридные) |
тетраэдр |
|
CH4, BF4─ |
|
|
|
|
|
|
|
|
AB5 |
|
sp3d (гибридные) |
тригональная |
|
PCl5 |
|
|
|
|
бипирамида |
|
|
|
|
|
|
|
|
|
|
AB6 |
|
Sp3d2(гибридные) |
октаэдр |
|
SF6 |
|
|
|
|
|
|
|
8.4. Полярность молекул
Полярность двухатомной молекулы зависит от значений электроотрицательности атомов. Полярность многоатомной молекулы
зависит от состояния центрального атома и от геометрии молекулы. Мерой полярности молекулы служит дипольный момент.
Дипольный момент – величина векторная, направленная от положительного конца диполя к отрицательному. Поэтому дипольный
момент многоатомной молекулы следует рассматривать как векторную сумму дипольных моментов связей. Дипольный момент зависит не только от полярности каждой связи, но и от взаимного расположения этих связей.
142
Рассмотрим возможные пространственные конфигурации молекул типа
АВ2.
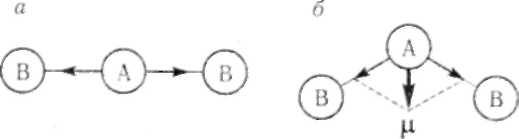
Рисунок 8.5. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения: а) линейное строение; б) угловое строение.
Молекула типа АВ2 может иметь линейную или угловую структуру. При линейном строении молекулы равные по величине дипольные моменты двух связей А—В противоположны по направлению (Рис.8.5.а). Следовательно, дипольный момент такой молекулы будет равен нулю µ=0,
значит молекула неполярна. Например, для молекулы BeCl2 |
дипольный |
||||
момент |
складывается |
из |
дипольных |
моментов |
связей |
μBeCl2 |
= μBe−Cl + μBe−Cl |
= 0 и |
равен нулю, |
несмотря на |
полярность |
каждой связи Be — Cl.
В случае углового строения молекулы векторная сумма дипольных моментов двух связей А — В отличается от нуля µ≠0, такая молекула обладает дипольным моментом и является полярной (Рис.8.5.б). Например, при образовании молекулы H2S электронные облака двух неспаренных 3рэлектронов («чистые» р – орбитали) атома серы (3s23р4) перекрываются с 1s – электронными облаками двух атомов водорода. Р-электронные облака ориентированы во взаимно перпендикулярных направлениях под углом 900. Дипольный момент молекулы равен сумме дипольных моментов связей и
отличается от нуля μH2S = μH −S + μH −S ≠ 0 . Следовательно, молекула
полярна.
Рассмотрим строение молекул типа АВ3.
143
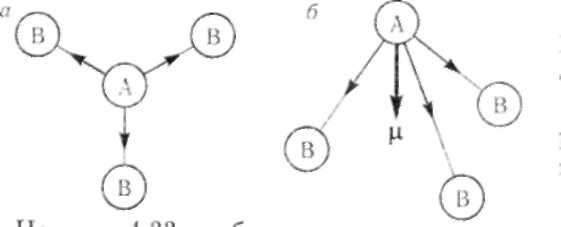
Если молекула построена в форме плоского треугольника ( например BF3), то векторная сумма дипольных моментов отдельных связей равна нулю
– молекула неполярна (Рис.8.6.а). У атома бора три эквивалентные sp2-
гибридные орбитали расположены в одной плоскости под углом 120° друг к другу. Несмотря на то, что каждая связь B—F в молекуле полярна,
векторная сумма дипольных моментов равна нулю и молекула в целом неполярна.
Если молекула имеет пирамидальное строение, то ее суммарный дипольный момент отличается от нуля – молекула полярна (например РH3) (Рис.8.6.б). Атом фосфора имеет на внешней оболочке три неспаренных р- электрона («чистые» р – орбитали), атомные орбитали которых расположены в пространстве под углом 90о (3s23р3). При образовании трех химических связей путем перекрывания атомных орбиталей фосфора с s – орбиталями трех атомов водорода возникает пирамидальная структура, где вектор
суммарного дипольного момента отличен от нуля. Следовательно, такая молекула будет полярной. μРН3 = 0,58D .
Таким образом, можно сделать следующий вывод, что гибридизация связей центрального атома приводит к тому, что молекулы и ионы оказываются неполярными.
Если связи образованы двумя или тремя «чистыми» р-орбиталями центрального атома, то молекулы полярны.
144
Рисунок 8.6. Дипольные моменты отдельных связей в молекулах типа АВ3 различного строения: а) плоский треугольник; б) пирамида.
145
ТЕМА 9. ЭЛЕКТРОХИМИЯ
Электрохимия – область химии, рассматривающая химические процессы, сопровождающиеся возникновением электрического тока, либо вызванные действием электрического тока.
Вещества делятся на две группы:
1.Изоляторы – плохо проводящие электрический ток.
2.Электрические проводники – хорошо проводящие электрический ток. Электрические проводники в свою очередь бывают двух типов:
1.Проводники первого рода – металлические или электронные проводники.
2.Проводники второго рода – электролиты.
Электрод – металл, проводник 1 рода, погруженный в раствор электролита в условиях прохождения через него тока.
Кпроводникам 1–го рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда – электроны.
Кпроводникам 2–го рода относятся расплавы и растворы электролитов; носители заряда – ионы.
На границе электрод – раствор электролита возникает скачок электрического потенциала (электродный потенциал).
9.1. Понятие об электродном потенциале
Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. В узлах кристаллической решетки металла расположены ион-атомы, находящиеся в равновесии со свободными электронами:
Ме+·е 
 Ме+ + е
Ме+ + е
146

При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной является реакция поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия происходит окисление металла и его гидратированные ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
Ме + mН2О → Ме(Н2О)mn+ + ne
Металл становится заряженным отрицательно, а раствор – положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл – раствор возникает двойной электрический слой (ДЭС) (Рис. 9.1). Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом или потенциалом электрода.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– – |
|
|
|
|
+ |
|
+ |
|
|
|
|||||
|
|
|
+ |
|
– – |
+ |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||
+ |
|
– – |
+ |
|
|
|
||||
|
|
+ |
|
– – |
+ |
|
|
|
||
|
|
|
||||||||
+ |
|
– – |
+ |
|
|
|
||||
+ |
|
– – |
+ |
|
|
|
||||
|
|
|
+ |
|
– – |
+ |
|
|
|
|
|
|
|
|
|||||||
+ |
|
– – |
+ |
|
|
|
||||
+ |
|
– – |
+ |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 9.1. Двойной электрический слой
По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла. Наряду с этой реакцией протекает обратная реакция – восстановление ионов металла до атомов:
Ме(Н2О)mn+ + ne → Ме + mН2О
147

С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной растет. При некотором значении электродного потенциала скорость прямого процесса будет равна скорости обратного процесса, устанавливается равновесие:
Ме + mН2О 
 Ме(Н2О)mn+ + ne
Ме(Н2О)mn+ + ne
Для упрощения гидратированную воду обычно в уравнение реакции не
включают и она записывается в виде: |
|
Ме |
Меn+ + ne |
Равновесие имеет динамический характер, процессы при равновесии идут с одинаковой скоростью в прямом и обратном направлениях.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Абсолютные значения электродных потенциалов экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимают равным нулю.
Стандартный водородный электрод
За нуль принят потенциал стандартного водородного электрода. Он представляет собой платиновую пластинку, покрытую платиновой чернью (высокодисперсная платина) и погруженную в 2Н раствор H2SO4, в котором активность ионов Н+ = 1 моль/л (Рис. 9.2). Через этот раствор под давлением 100 кПа при температуре 25 оС пропускается газообразный чистый водород, который адсорбируется платиной. На электроде происходит процесс:
Н2 – 2е 
 2Н+ Между насыщенной водородом платиновой пластинкой и раствором
2Н+ Между насыщенной водородом платиновой пластинкой и раствором
возникает скачок потенциала. Абсолютное значение потенциала водородного
148
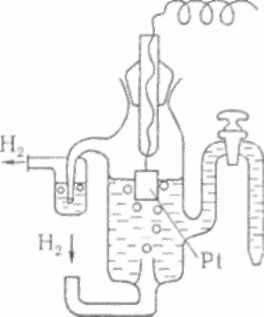
электрода неизвестно, но условно он принимается за нуль, так как он воспроизводится с высокой точностью. Поэтому водородный электрод принят в качестве эталона при создании шкалы электродных потенциалов.
Рис. 9.2. Водородный электрод
9.2. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванический элемент – это прибор, в котором химическая энергия превращается в электрическую, благодаря протекающим процессам окисления-восстановления.
В основе работы гальванического элемента лежит химическая реакция вытеснения одного металла, менее активного, другим, более активным из раствора его соли.
Теоретический и практический интерес представляют гальванические элементы с металлическими электродами.
Рассмотрим, например, реакцию, которая может быть осуществлена двумя путями
Zn (тв) + CuSO4(р-р) = ZnSO4 (р-р) + Cu(тв)
149
+ Cu2+ = Zn2+ + Cu(тв)
Если цинковую пластину поместить в раствор медного купороса, то произойдет выделение металлической меди и растворение цинка:
Zn0 – 2е → Zn2+; Cu2+ + 2е → Cu0
Электроны переходят от цинка непосредственно к меди, и реакция протекает необратимо – без производства работы, сопровождается только выделением тепла.
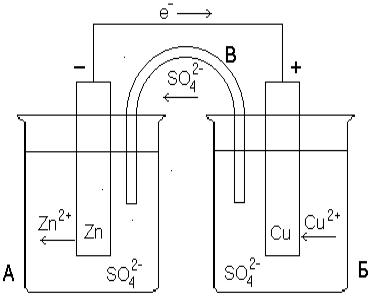
Можно создать условия, в которых электроны будут двигаться по металлическому проводнику и совершать работу. Это достигается в гальваническом элементе, примером которого может служить элемент Даниэля-Якоби, где цинковый электрод погружен в раствор ZnSO4, медный электрод – в раствор CuSO4 (Рис.9.3). Растворы отделены друг от друга пористой (керамической) перегородкой, препятствующей их смешению.
Рис.9.3. Схема медно-цинкового гальванического элемента.
На обоих электродах образуются двойные электрические слои, в результате чего возникают электродные потенциалы цинка и меди. Т.к. цинк более активен и потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. При этом ионы
150
