
andruhova
.pdf11.4.Виды электрохимической коррозии
1.Коррозия в электролитах – в водных растворах солей, кислот, щелочей, в морской воде.
Химическая арматура, цистерны для транспортировки химической продукции, корпуса морских и речных судов, подводные сооружения в портах, доках и т.д. Например, коррозия в морской воде идет с кислородной деполяризацией. Здесь возникает концентрационный гальванический элемент за счет разницы концентрации кислорода в воде и воздухе.
2.Атмосферная коррозия – коррозия во влажном воздухе при обычных температурах.
Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь – кислород. Пленка влаги играет роль электропроводной среды. Скорость атмосферной коррозии зависит от влажности воздуха и содержании в нем газов, образующих с водою кислоты (CO2, SO2 и др.)
3.Почвенная коррозия приводит к разрушению подземных сооружений: трубопроводов, оболочек кабелей, деталей строительных сооружений.
Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от грунтовых вод, а также от структуры
иминералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
4.Коррозия под влиянием блуждающих токов.
Его источниками являются установки, работающие на постоянном токе: электросварочные аппараты, трамваи и т.д. Блуждающие ток возникают и в конструкциях приборов при нарушении изоляции. Если на пути блуждающих токов встретится металлическая труба, которая оказывает меньшее сопротивление прохождению тока, то ток входит в трубу, некоторое время протекает по ней и в каком-то месте выходит из нее. Место входа
171
блуждающего тока из почвы в трубу является катодным участком, а место выхода его из трубы – анодным. Анодные участки рельса и трубы разрушаются в результате окисления железа. На катодных участках восстанавливаются ионы водорода (при отсутствии более электроположительных ионов). Величина блуждающего тока определяет интенсивность коррозии и степень разрушения конструкции.
Факторы, влияющие на интенсивность коррозии металла
1.Химический состав металла – создан ряд сплавов железа, которые лучше противостоят коррозии, чем само железо.
2.Структура металла – сплавы с однородной структурой более устойчивы к коррозии.
3.Механическая обработка металла – она вызывает внутреннее напряжение, т.к. меняет порядок расположения атомов в кристаллической решетке.
4.Состояние поверхности металла. Наличие на поверхности металла плотной, хорошо сцепляющей пленки оксида уменьшает коррозию (Cr, Ni, Al, Zn, Ti. Ta, Zr и др.)
5.Химический состав и свойства среды. Чем выше кислотность раствора (т.е. меньше рН), а также чем больше в нем содержание окислителей, тем быстрее протекает коррозия. Повышение температуры способствует увеличению коррозии металла, т.к. при этом разрушается пассивирующая пленка.
11.5.ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Безвозвратные потери металлов от коррозии составляют 15% от ежегодного их выпуска. В результате постепенного разрушения металла
172
механические свойства и внешний вид изделия заметно ухудшаются, и оно рано или поздно приходит в негодность. Поэтому имеют очень большое значение методы защиты металлов и сплавов от коррозии. Они весьма разнообразны и используются с целью изоляции поверхности металлов от внешней среды, чтобы не было деполяризатора.
При выборе вида защиты исходят из того, в каких условиях предстоит работать изделию из данного металла.
I. Защитные поверхностные покрытия металлов. Они бывают:
•Металлические (цинк, олово, свинец, никель, хром и др.).
•Неметаллические (лаки, краски, эмали).
Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических.
Металлические покрытия по характеру защитного действия делятся на анодные и катодные. Эти покрытия не отличаются друг от друга, пока не поврежден защитный слой.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr | H2O, O2 | Fe (+) К на аноде: Cr – 2e → Cr2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Продукт коррозии: Cr2+ + 2 OH– → Cr(OH)2 Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
173

4 Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
А (–) Fe | H2O, O2 | Sn (+) К на аноде: Fe – 2e → Fe2+
на катоде: 2 H2O + O2 + 4e → 4 OH–
Продукт коррозии: Fe2+ + 2 OH– → Fe(OH)2
Разрушается защищаемый металл.
Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
Неметаллические покрытия
1. Лаки, краски используются в том случае, когда поверхностный слой сплошной.
174
2. Оксидные пленки (Fe, Cr, Ni, Al, Zn, и др.). Они устойчивы на воздухе, но толщина естественных пленок 1-2 молекулы. На практике применяют метод создания искусственных оксидных пленок:
•Химическое оксидирование или воронение (сталь в растворе NaOH, NaNO2, NaNO3 при температуре 135-140 0C. Образуется оксидная пленка Fe2O3 1-2 µк)
•Электрохимическое оксидирование алюминия – анодирование (на алюминий наносится 20% раствор H2SO4 , образуется оксидная пленка
Al2O3 от 1,5-20 µк).
II. Электрохимическая защита.
Этот метод защиты основан на торможении анодных и катодных реакций коррозионного процесса.
Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
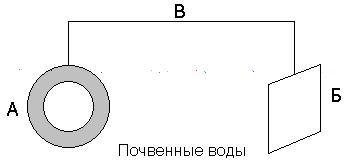
Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 8.3).
Рисунок 11.3. Схема протекторной защиты. А – трубопровод; Б – протектор; В – проводник
175
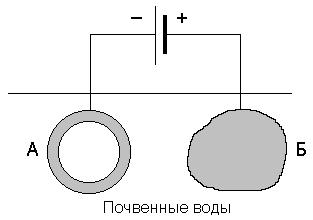
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока
(рисунок 11.4).
Рисунок 11.4. Схема катодной защиты. А – конструкция; Б – протектор.
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
III.Изменение свойств коррозионной среды.
1.Деаэрация – удаление из раствора растворенного кислорода. С этой целью используют специальные вещества или кипячение.
2.Максимально замедлить процесс коррозии можно путем введения в
окружающую среду специальных веществ – ингибиторов. Они каталитически снижают скорость коррозии (нитриты, хроматы, фосфаты). Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
3.Изменение рН среды – подщелачивание.
176
4.IV. Создание сплавов с антикоррозионными свойствами
Всостав сплава вводятся компоненты, вызывающие пассивность металла (хром, никель, вольфрам и др.)
177
ТЕМА 12. ПОЛИМЕРЫ
12.1. Классификация и методы получения полимеров
Вещества, состоящие из молекул больших размеров, большой молекулярной массы (порядка сотен, тысяч, миллионов и больше),
называются высокомолекулярными соединениями (ВМС). К ним относятся соединения полимерного и неполимерного строения.
Молекулы полимеров, называемые также макромолекулами (ММ), состоят из большого числа повторяющихся звеньев. Полимеры остаются практически неизменными при добавлении или удалении одного или нескольких составных звеньев (СЗ).
Отдельную группу составляют олигомеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями. Они также включают определенное число составных звеньев, но при этом любое изменение числа таких звеньев приводит к изменению физических (иногда и химических) свойств веществ. Обычно число СЗ в молекулах олигомеров не превышает 100.
Исходные вещества, используемые для получения полимеров и олигомеров и образующие одно или несколько СЗ, называются мономерами.
Индивидуальные свойства полимера определяются размером его макромолекулы и ее строением. Размер макромолекулы характеризуется числом повторения составных звеньев, называемых степенью полимеризации (n). Поэтому обобщенная формула макромолекулы полимера записывается указанием СЗ в скобках и степени полимеризации:
─ [─ СЗ─ ]n ─
Строение ММ определяется составом и количеством атомов, входящих в СЗ, характером соединения СЗ между собой, пространственным расположением отдельных частей ММ относительно других ее частей.
178
В соответствии с основным делением химических соединений, по типу входящих в составное звено элементов, можно выделить
неорганические, органические и элементорганические полимеры.
По происхождению полимеры бывают:
•природные (встречаются в природе, например, натуральный каучук, крахмал, целлюлоза, белки),
•модифицированные (дополнительно измененные природные полимеры, н-р, резина),
•синтетические (полученные методом синтеза).
По характеру соединения СЗ в составе ММ различают полимеры
линейные, разветвленные, лестничные, трехмерные сшитые и их видоизменения.
По отношению к нагреванию выделяют термопластичные и
термореактивные.
По типу химической реакции, используемой для получения, различают полимеризационные (р-я полимеризации) и поликонденсационные (р-я поликонденсации) полимеры.
Реакция полимеризации – процесс, в результате которого молекулы НМС (мономера) соединяются друг с другом при помощи перестройки ковалентных связей, образуя новое вещество (полимер), ММ которого в целое число раз больше, чем у мономера; полимеризация характерна, главным образом, для соединений с кратными (двойными или тройными ) связями.
По числу видов участвующих мономеров различают гомополимеризацию (один вид мономера) и сополимеризацию (два и более видов мономеров).
Полимеризация – самопроизвольный экзотермический процесс ( G<0, H<0), так как разрыв связей ведет к уменьшению энергии системы. Однако без внешних воздействий (инициаторов, катализаторов и т.д.) полимеризация
179
протекает обычно медленно. Полимеризация является цепной реакцией. В зависимости от характера активных частиц различают радикальную и ионизационную полимеризацию.
При радикальной полимеризации процесс инициируется свободными радикалами. Реакция проходит через несколько стадий: а) инициирование – образование активных центров – радикалов и макрорадикалов – происходит в результате теплового, фотохимического, химического, радиационного или др. видов воздействий;
б) рост цепи происходит за счет присоединения к радикалам образующихся мономеров с получением новых радикалов;
в) передача или обрыв цепи. Передача заключается в переносе активного центра на другую молекулу, в результате рост цепи прекращается, а молекула-передатчик инициирует новую реакционную цепь.
Ионная полимеризация также происходит через стадию образования активных центров, роста и обрыва цепи. Роль активных центров в этом случае играют анионы и катионы. Соответственно различают анионную и катионную полимеризацию.
Реакция поликонденсации – процесс образования полимера из НМС, содержащих две или несколько функциональных групп, сопровождающийся выделением за счет этих групп таких веществ, как вода, аммиак, галогеноводород и т.п.; состав элементарного звена полимера в этом случае отличается от состава исходного полимера.
Поликонденсация протекает по ступенчатому механизму, при этом промежуточные продукты являются стабильными, т. е. поликонденсация может остановиться на любой стадии. Образующиеся низкомолекулярные продукты реакции (H2O, NH3, HCl, CH2O и др.) могут взаимодействовать с промежуточными продуктами поликонденсации, вызывая их расщепление (гидролиз, аминолиз, ацидолиз и др.)
180
