
andruhova
.pdfлитре раствора(V). Например, 2н раствор. Это означает, что 2 молярные массы эквивалента вещества растворено в 1 литре раствора.
СN = nЭ/ V = mв-ва /MЭ*Vр-ра, где МЭ – молярная масса эквивалента.
Мольная доля (Ni). Это отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из растворителя и растворенного вещества, мольная доля последнего (N2) равна
N2 = n2/(n1+ n2),
а мольная доля растворителя (N1) равна
N1= n1/(n1+n2),
где n1 и n2 соответственно количества вещества растворителя и растворенного вещества.
Сумма мольных долей всех компонентов раствора равна 1.
Моляльная концентрация или моляльность (Сm) показывает количество растворенного вещества (n = m/M ), приходящееся на 1 кг растворителя (mр-ля) . Например: 1,5 моль/кг. Это означает, что в растворе содержится 1,5 моль вещества и 1 кг растворителя.
Сm = n/ mр-ля = mв-ва/M *mр-ля
Титр раствора (Т) показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора.
Т = mв-ва /Vр-ра
71
6.2.РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
Взависимости от того, электронейтральными или заряженными частицами являются компоненты раствора, их подразделяют на
молекулярные (растворы неэлектролитов) и ионные (растворы электролитов). Одна из характерных особенностей растворов электролитов заключается в том, что они проводят электрический ток.
Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы.
Соответственно, образование этих растворов не сопровождается тепловым эффектом (∆Н=0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам по своим свойствам приближаются лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества.
Общими свойствами являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Они также называются коллигативными
(коллективными). Такие свойства могут проявляться в полной мере в идеальных растворах.
Кобщим свойствам растворов относятся:
•понижение давления насыщенного пара растворителя над раствором;
•понижение температуры замерзания;
•повышение температуры кипения;
•осмотическое давление.
Эти свойства проявляются в случае растворов нелетучих растворенных веществ, т.е. веществ, давлением паров которых можно пренебречь.
72
6.2.1.Закон Рауля
Ирастворитель, и растворенное вещество оказывают значительное влияние друг на друга и взаимно изменяют свои свойства.
Степень этого влияния зависит от природы того и другого вещества. Между частицами растворителя и растворенного вещества возможны самые разнообразные типы взаимодействий. Взаимодействия, проявляющиеся в растворе, обнаруживаются при сопоставлении свойств чистого растворителя
ирастворов с различной концентрацией растворенного вещества.
Одно из важнейших термодинамических свойств чистых жидкостей и растворов - давление насыщенного пара. Предположим, что происходит испарение чистого растворителя А (рис. 6.3,а). На поверхности раздела жидкой и газообразной фазы существует равновесие перехода «жидкость-газ» и над жидкостью её парами создаётся избыточное давление, называемое равновесным давлением.
Равновесное давление пара представляет собой меру способности молекул переходить из жидкой фазы в газовую фазу. Эта способность больше при высоких температурах и меньше при пониженных температурах. Она снижается при уменьшении числа молекул жидкости способных испаряться.
При растворении вещества В в веществе А число молекул А в единице объема уменьшается, а значит, снижается и их число на единице поверхности испаряющейся жидкости (рис. 6.3,б). Тем самым уменьшается скорость испарения и снижается парциальное давление насыщенного пара растворителя над раствором.
Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Французский ученый Р. Рауль открыл закон, согласно которому понижение давления насыщенного пара растворителя А над раствором ∆рА
73

А |
А |
А А |
А |
А |
А |
АА А
АА А А А А А А
АА А А А А А А
АА А А А А А А
АА А А А А А А
А |
|
А |
А |
А |
А |
|
А |
А |
ААВА В А АВА А АВА А В А В А В
ВА В А А В А В А
АВ А А В А В
а б
Рис.6.3. Схема испарения чистого растворителя А (а) и растворителя из раствора, содержащего вещество В (б)
пропорционально молярной доле растворенного нелетучего вещества
хВ:
роА - рА = ∆рА = роА хВ,
где роА – давление насыщенного пара растворителя над чистым растворителем;
рА – давление насыщенного пара растворителя над раствором; ∆рА – разность между этими давлениями; хВ – молярная доля растворенного нелетучего вещества.
Из уравнения следует, что с увеличением содержания нелетучего растворенного компонента давление пара растворителя над раствором уменьшается.
Из закона Рауля возникают два следствия. Согласно одному из них
температура кипения раствора выше температуры кипения растворителя.
Согласно второму следствию температура замерзания раствора
ниже температуры замерзания чистого растворителя.
Т.е. присутствие растворенного вещества в растворе повышает температуру кипения ТК и понижает ТЗ (или температуру плавления твердой фазы, что одно и то же) растворителя, тем сильнее, чем концентрированней
74
раствор. В большинстве случаев из раствора кристаллизуется (при замерзании) или выкипает (при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это приводит к еще большему повышению ТК и снижению ТЗ.
Разность между температурами кипения раствора Ткип и чистого растворителя Т/кип называют повышением температуры кипения раствора ∆ТК.
Разность между температурами замерзания чистого растворителя Т/з и раствора Тз называют понижением температуры замерзания раствора ∆ТЗ.
Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давление 101,3 кПа кипит при 100 0С потому, что при этой температуре давление водяного пара как раз равно 101,3. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до 101,3 кПа, нужно нагреть раствор выше 100 градусов. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Изучая замерзание и кипение растворов, Рауль установил, что для
разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:
∆ТК =Ткип -Т/кип= ЕТсм (В) |
∆ТЗ =Т/з - Тз = КТсм(В) см(В)=m/МВ |
75
где ТК, ТЗ – температуры кипения и замерзания раствора; Т/ - значения для чистого растворителя; ∆ТК - повышением температуры кипения раствора;
∆ТЗ - понижением температуры замерзания раствора.
СМ(В) – моляльность, т.е. число молей вещества на 1 кг растворителя;
МВ – молярная масса вещества; ЕТ, КТ – эбулиоскопическая и криоскопическая постоянные,
зависящие только от природы растворителя, но не зависящие от природы растворенного вещества.
Для воды К=1,86; Е= 0,52. Для бензола К=5,07; Е= 2,6.
На измерениях температур кипения и замерзания растворов основаны
эбулиоскопический и криоскопический методы определения молекулярных масс веществ. Оба метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
6.2.2. Осмотическое давление
Поведение растворенных веществ во многом напоминает поведение газов - они стремятся к взаимной диффузии и как следствие к равномерному распределению по всему объему системы.
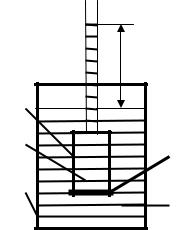
Если сосуд 1 (рис.6.4), закрытый внизу полупроницаемой перегородкой (мембраной) 2, наполнить водным раствором какого-либо вещества и поместить в сосуд 3 с водой, то вода будет переходить из сосуда 3 в 1. Через некоторое время объем раствора в сосуде 1 увеличится и его уровень поднимется выше уровня растворителя в сосуде 3 на высоту h.
76
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом.
Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба. Количественно осмос
характеризуется осмотическим давлением, равным по силе, приходящейся на единицу площади поверхности, и заставляющей молекулы растворителя проникать через полупроницаемую перегородку
(мембрану). Оно равно давлению столба раствора в осмометре высотой h. При равновесии внешнее давление уравновешивает осмотическое давление. В этом случае скорости прямого и обратного перехода молекул через полупроницаемую перегородку становятся одинаковыми.
Если внешнее давление, приложенное к более концентрированному раствору, выше осмотического π, т.е. Р > π, то скорость перехода молекул растворителя из концентрированного раствора будет больше, и растворитель будет переходить в разбавленный раствор (или чистый растворитель). Этот процесс, называемый обратным осмосом,
используется для очистки природных и сточных вод, для получения питьевой воды из морской воды.
77
|
h |
1,3- сосуд ; |
|
|
|
||
1 |
|
2 |
– полупроницаемая |
|
мембрана; |
||
5 |
2 |
4 |
– вода; |
5 |
– раствор. |
||
3 |
4 |
|
|
|
|
|
|
|
Рис.6.4. Схема осмометра |
|
|
Мембранами могут служить как природные пленки, так и пленки, полученные искусственным путем. В природе мембранами являются стенки клеток, они образуют протяженные двухслойные структуры малой толщины (6-10 нм). Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры.
Вант-Гофф предположил, что для осмотического давления можно применить уравнение состояния идеального газа
πV = nRT или π = nRT/V, откуда π = cRT,
где π – осмотическое давление; с – молярная концентрация раствора.
Осмос играет очень важную роль в биологических процессах, обеспечивая поступление воды в клетки и другие структуры.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим, если ниже внутриклеточного - гипотоническим. Например, среднее осмотическое давление крови при 36 оС равно 780 кПа.
78
Гипертонические растворы сахара (сироп) и соли (рассол) широко применяются для консервирования продуктов, так как вызывают удаление воды из микроорганизмов.
79

6.3. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
6.3.1. Электролитическая диссоциация
Согласно теории электролитической диссоциации соли, кислоты, основания, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией.
Вещества, диссоциирующие на ионы в растворах, называют электролитами.
В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами; к ним относятся, например, ионы водорода и металлов.
Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α)
называется отношение числа его молекул, распавшихся в данном растворе на ионы (n), к общему числу его молекул в растворе (N), или
α = Nn
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3
80
