
andruhova
.pdf
Закон Гесса справедлив для тех взаимодействий, которые протекают в изобарно-изотермических (Р,Т = const) или изохорно-изотермических (Т,V = const) условиях.
Проиллюстрируем применение закона Гесса схемой образования углекислого газа при окислении графита:
ΔΗ
С(графит)  CO2 (г)
CO2 (г)
ΔΗ1 |
ΔΗ2 |
|
CO (г) |
Углекислый газ может быть получен в одну стадию; тепловой эффект этой стадии равен H. Двухстадийный путь состоит в окислении графита сначала до CO (тепловой эффект стадии равен H1), а затем до CO2 (тепловой эффект
H2). При обоих способах проведения процесса система переходит из одного и того же начального состояния (графит) в одно и то же конечное
(углекислый газ), поэтому, согласно закону Гесса, H= H1+ H2.
В химических справочниках невозможно привести тепловые эффекты всех реакций. Но из закона Гесса можно получить важные следствия,
позволяющие вычислить H почти всех процессов. Для этого введем определения.
Стандартной теплотой образования вещества называется тепловой эффект реакции получения 1 моля этого вещества из простых веществ
при стандартных условиях (обозначается H of , кДж/моль).
Энтальпии образования зависят от температуры. Стандартные значения энтальпии образования вещества H of приводятся в справочнике, относятся к температуре 298 К и давлению 101 кПа, выражаются кДж/моль. Для простых
31
веществ принимается H of = 0 , если их агрегатные состояния или
модификации устойчивы при стандартных условиях.
Т.о. по стандартным значениям энтальпии образования вещества
H of можно рассчитать тепловой эффект реакции.
Следствие из закона Гесса: тепловой эффект химической реакции равен разности между суммой стандартных энтальпий образования продуктов и суммой стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
H298o = ∑nпр· ∆Hof (прод.) ─ ∑ nисх· ∆Hof (исх.)
H298o = [кДж]
Задача. Вычислить тепловой эффект реакции:
2Mg(к) + СО2 (г) = 2MgО(к) + С(графит)
∆Hof (MgO) = -601,8 кДж/моль, ∆Hof (CO2) = -393,5 кДж/моль.
Согласно следствию закона Гесса тепловой эффект данной реакции равен
H298o = 2·∆Hof (MgO) ─ ∆Hof (CO2)
H298o = 2(- 601,8) – (-393,5) = - 810,1 кДж
Можно также рассчитать значение энтальпии образования одного из исходных веществ или продуктов реакции, если известны энтальпии образования остальных реагентов и энтальпия химической реакции.
3.4. Направленность химических процессов
Многие процессы протекают без подвода энергии от внешнего источника. Такие процессы называются самопроизвольными. Примерами самопроизвольных процессов могут служить падение камня с высоты, течение воды под уклон, переход теплоты в помещении от более нагретого тела к менее нагретому. Человеческий опыт показал, что самопроизвольные процессы в обратном направлении не могут протекать самопроизвольно, т.е.
32
самопроизвольно не потечет вода в гору, камень не полетит вверх, а теплота не перейдет от холодного тела к нагретому. В механических системах самопроизвольно протекают процессы, в которых уменьшается потенциальная энергия, т.е. критерием самопроизвольности служит
неравенство Eп<0.
Многие химические реакции также протекают самопроизвольно, например, образование ржавчины на металлах, реакция натрия с водой, растворение соли в воде и т.д.
Чтобы понимать химические процессы и управлять ими, необходимо знать ответ на вопрос: каковы движущие силы и критерии
самопроизвольных химических процессов?
Одной из движущих сил химической реакции является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Как показывает опыт, большинство экзотермических реакций протекает самопроизвольно. Однако условие H° < 0 не может быть критерием самопроизвольного течения химических реакций, так как существуют самопроизвольные эндотермические химические реакции, например, растворение некоторых солей в воде (KCl, NH4NO3).
Следовательно, кроме уменьшения энтальпии системы имеется другая движущая сила самопроизвольного процесса. Такой силой является стремление частиц к хаотичному движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному.
Самопроизвольное направление протекания химических реакций определяется совместным действием двух факторов:
1.Тенденция к переходу системы в состояние с наименьшей внутренней энергией (энтальпией)
2.Тенденция к достижению наиболее вероятного состояния, т.е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний)
33

Количественной мерой беспорядка системы служит термодинамическая функция, получившая название энтропии.
Состояние системы можно характеризовать микросостояниями составляющих её частиц. Число микросостояний системы называется
термодинамической вероятностью системы W. Так как число частиц в системе огромно (1 моль содержит 6,02 • 1023 частиц), то термодинамическая вероятность системы выражается огромными числами. Поэтому пользуются логарифмом термодинамической вероятности lnW.
Величина R•lnW = S, называется энтропией системы. R- газовая постоянная
W- число микросостояний (термодинамическая вероятность).
Представим, что баллон со сжатым воздухом соединен с вакуумированным сосудом. Если открыть баллон, то газ выходит из баллона и равномерно распределяется по всему объему сосуда. При этом система из более упорядоченного состояния переходит в состояние с менее упорядоченное: увеличивается число микросостояний W, энтропия возрастает. Обратный процесс связан с уменьшением энтропии и он менее вероятен. В данном случае невероятно, чтобы газ сам собой собрался в баллоне.
Таким же образом наблюдается увеличение энтропии при переходе жидкости в пар, при растворении кристаллического вещества и т.д. Во всех случаях наблюдается уменьшение порядка в относительном расположении частиц.
Например, рассмотрим изменение состояния воды. При Т= 100 оС вода переходит в пар. Молекулы воды в паре имеют большую скорость, чем в жидкости. Термодинамическая вероятность состояния WЖ < WП => SГ >SЖ. Понижаем Т до 0 оС, вода переходит в лед. Т.к. молекулы воды как бы закрепляются в узлах кристаллической решетки WК < WЖ => SК < SЖ, следовательно, падает и энтропия. Итак, при постоянном давлении энтропия
34
является функцией от температуры. По мере повышения температуры растет скорость различных видов движений частиц, т.е. число их микросостояний и соответственно термодинамическая вероятность и энтропия вещества.
Состояние |
Лёд |
← |
Жидкость |
→ |
Пар |
|
|
|
|
|
|
Термодинамическая |
WК |
< |
WЖ |
< |
WП |
вероятность |
|
|
|
|
|
|
|
|
|
|
|
Энтропия |
SК |
< |
SЖ |
< |
SП |
Энтропия вещества в стандартном состоянии называется стандартной энтропией S0298 и имеет единицу измерения Дж/(моль·К), её значения приводятся в справочниках. В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии.
Согласно следствию из закона Гесса, изменение энтропии системы в результате протекания химической реакции равно разности между суммой стандартных энтропий продуктов реакции и суммой стандартных энтропий исходных веществ с учетом стехиометрических коэффициентов.
S298o = ∑nпр· So (прод.) ─ ∑ nисх· So(исх.)
S298o = [Дж/К]
Знак S можно легко определить, не пользуясь справочником, если неупорядоченность системы резко изменяется в ходе реакции:
CaCO3(т) → CaO(т) + CO2(г)
В продуктах реакции имеется газообразное вещество, его энтропия существенно выше, чем в жидком и твердом состояниях. Следовательно,
S>0.
II закон термодинамики для изолированных систем:
35
В изолированных системах самопроизвольно идут только те процессы,
которые сопровождаются возрастанием энтропии S>0.
Системы, в которых протекают химические реакции, не бывают изолированными, т.к. они сопровождаются изменением внутренней энергии системы (тепловым эффектом реакции), т.е. система обменивается энергией с окружающей средой. Химические реакции обычно сопровождаются
изменением как энтропии, так и энтальпии.
В процессе химических реакций одновременно действуют две тенденции:
1.Стремление частиц объединиться в более сложные, что уменьшает энтальпию H.
2.Стремление частиц разъединиться, что увеличивает энтропию
S.
Суммарный эффект этих двух противоположных тенденций отражается изменением энергии Гиббса G (изобарно-изотермический потенциал) в процессах, протекающих при Т,Р = const. Т.к. энергию Гиббса можно превратить в работу, её называют свободной энергией.
G= H–T S
Умножение температуры на изменение энтропии делает размерности обоих факторов соответствующими друг другу.
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции:
1. G < 0 => самопроизвольное протекание реакции в прямом направлении возможно (преобладание энтальпийного фактора)
2.G > 0 => самопроизвольное протекание реакции в прямом направлении невозможно, возможно протекание обратной реакции (преобладание энтропийного фактора)
3.G = 0 => в системе устанавливается равновесие
36
H=T S => ТР= |
Н |
|
|
S |
|||
|
|||
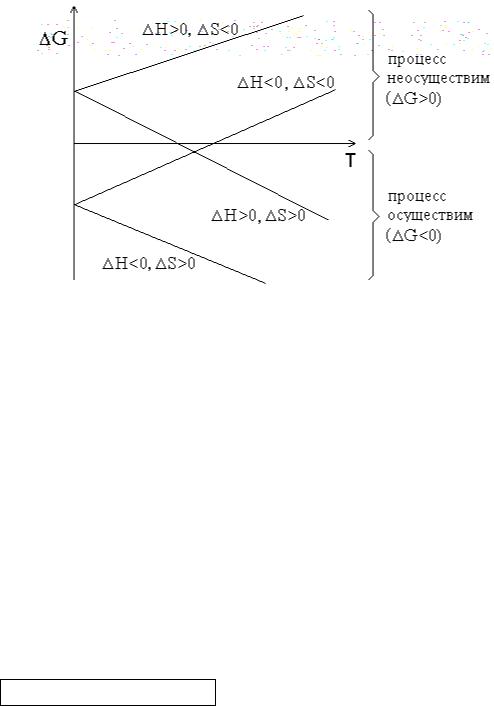
График зависимости G от температуры может иметь различный вид |
|||
в зависимости от знаков |
H и S (рисунок 1.1). |
||
Рисунок 3.1 – Графики зависимостей G от температуры.
Из рисунка 1.1 видно, что при H<0 и S>0 процесс протекает самопроизвольно при любых температурах. Напротив, при H>0 и S<0
процесс принципиально неосуществим. Если же знаки H и S совпадают, то реакция может протекать самопроизвольно в некотором интервале температур. Если H=0 (реакция не сопровождается тепловым эффектом), то возможность протекания процесса полностью определяется энтропией. В
случае, когда S=0 определяющую роль играет энтальпийный фактор.
Зная величины H0298 реакции и S0298 реакции можно рассчитать
GТ реакции при заданной температуре по формуле:
GТ = H0298 –T S0298 и соответственно предсказать возможность
или невозможность самопроизвольного течения реакции, а также влияние температуры на направление процесса.
37
Как и любая термодинамическая функция, энергия Гиббса является функцией состояния, т.е. ее значение не зависит от пути протекания процесса, а лишь от исходного и конечного состояний системы. Поэтому
энергию Гиббса можно рассчитать как разность между суммой стандартных энергий Гиббса образования продуктов и суммой стандартных энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов
G298o = ∑nпр· ∆Gof (прод.) ─ ∑ nисх· ∆Gof (исх.)
G298o = [кДж]
Стандартной энергией Гиббса образования вещества называется изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ при стандартных условиях ( G0f ; кДж/моль)
Стандартная энергия Гиббса образования простого вещества ∆Gof принимается равной нулю.
38
ТЕМА 4. ХИМИЧЕСКАЯ КИНЕТИКА
Химическая термодинамика изучает возможность, направленность и пределы самопроизвольного течения химических процессов. Но этих знаний еще не достаточно, чтобы предсказать реальную возможность химической реакции. Быстрота реакции и ее механизм зачастую не связан со значением её энергии Гиббса.
Н2 + 1/2О2 = Н2О(Ж); |
∆G0298 = -237,2 кДж |
(1) |
Н+ + ОН─ = Н2О(Ж); |
∆G0298 = -79,9 кДж |
(2) |
Термодинамическая возможность реакции (1) больше, чем реакции (2). Но реакция (1) в обычных условиях не идет, а (2) протекает мгновенно.
Для управления химическими процессами важно представление о скоростях химических реакций и факторах, влияющих на скорость реакций.
Область химии, изучающая молекулярный механизм химических реакций, скорость их протекания и зависимость ее от различных факторов называется химической кинетикой.
Известно, что скорость химических реакций неодинакова. Например, реакция разложения взрывчатых веществ заканчивается за 1*10-6 сек, а взаимодействие Н2 и О2 при обычной температуре требует около 54 млрд. лет.
Реакции могут быть гомогенные и гетерогенные.
Гомогенные реакции протекают в однородной среде (газ, жидкость) равномерно во всем объеме, в пределах одной фазы.
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
Такая реакция протекает практически мгновенно (в водных растворах). Гетерогенные реакции протекают в неоднородной среде, между веществами, которые находятся в разных фазах (т-ж; ж-г) на поверхности
раздела фаз.
Zn(тв) + 2НСl(ж) = ZnCl2 + H2(г)↑
39
Данная реакция протекает на поверхности металла и длится некоторое время.
4.1. Скорость химической реакции
Скорость химической реакции – число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
Элементарный акт состоит в таком соударении и дальнейшем взаимодействии молекул, таком перераспределении электронной плотности, образовании новых и разрыве старых химических связей, когда образуются новые по составу и строению вещества.
Мерой скорости химической реакции называется количество вещества, вступающего в реакцию или образовавшегося при реакции.
Мерой скорости химической реакции могут быть и другие величины, например, изменение объема выделяющегося газа, вязкости раствора, его оптической плотности и др. Но все эти способы выражения скорости реакции в конечном итоге сводятся к изменению количества вещества.
Скоростью химической реакции υ называется изменение
концентрации реагента или продукта за единицу времени в единице реакционного пространства.
Если в момент времени t1 и t2 концентрации реагента или продукта равна С1 и С2 , то среднюю скорость υср в интервале времени t1 и t2 можно выразить
как:
ν |
СР |
= ± |
С2 |
−С1 |
= ± C |
|
|
||||
|
|
t2 |
−t1 |
t |
|
|
|
|
«–» говорит о том, что концентрация исходного вещества уменьшается в процессе реакции.
40
