
andruhova
.pdf
Так, синтез аммиака представляет собой экзотермическую реакцию
N2 + 3 H2 = 2NH3 ; ∆Н= -92,4 кДж
Поэтому при повышении температуры равновесие в системе сдвигается влево - в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты (∆Н > 0). При понижении температуры равновесие сдвигается вправо – в сторону образования аммиака, так как этот процесс идет с выделением теплоты(∆Н < 0).
Изменение внешних условий |
Влияние на смещение положения |
|||||||
|
|
|
|
|
равновесия |
|
||
|
Увеличивает |
скорость |
реакции, |
|||||
Повышение концентрации реагентов |
||||||||
(или |
понижение |
концентрации |
использующей |
вводимое |
вещество, |
|||
продуктов реакции) |
|
|
т.е. смещает равновесие в сторону |
|||||
|
|
|
|
|
продуктов реакции |
|
|
|
Понижение |
концентрации |
реагентов |
Увеличивает |
скорость |
реакции, |
|||
(или |
повышение |
концентрации |
протекающей |
с |
образованием |
|||
продуктов реакции) |
|
|
вещества, концентрация |
которого |
||||
|
|
|
|
|
понижается, |
т.е. |
|
смещает |
|
|
|
|
|
равновесие в сторону реагентов |
|||
Повышение |
давления |
(или |
Увеличивает |
скорость |
реакции, |
|||
уменьшение объёма) |
|
|
протекающей с уменьшением объема, |
|||||
|
|
|
|
|
т.е. смещает равновесие в сторону |
|||
|
|
|
|
|
уменьшения числа молей |
|
||
Понижение |
давления |
(или |
Увеличивает |
скорость |
реакции, |
|||
увеличение объёма) |
|
|
протекающей с увеличением объема, |
|||||
|
|
|
|
|
т.е. смещает равновесие в сторону |
|||
|
|
|
|
|
увеличения числа молей |
|
||
|
|
Увеличивает |
|
|
скорость |
|||
Повышение температуры |
|
|
|
|||||
|
|
|
|
|
эндотермической реакции (∆Н>0) |
|||
Понижение температуры |
|
Увеличивает |
|
|
скорость |
|||
|
|
|
|
|
экзотермической реакции |
(∆Н<0) |
||
|
|
|
|
|
|
|
|
|
61
5.3.4. Влияние катализатора
Существенное влияние на протекание химических процессов оказывают катализаторы. Их присутствие не влияет на термодинамику реакций, т.е. они не изменяют энтальпию и энергию Гиббса реакции. Если энергия Гиббса реакции положительна, то в присутствии катализаторов она не станет самопроизвольной. Введение катализатора в равновесную систему не может вызвать смещения равновесия. Он может ускорять наступление химического равновесия, но не влияет на константу равновесия. Катализатор увеличивает константу скорости химической реакции. Так как константа равновесия равна отношению констант скоростей прямой и обратной реакций, и от катализатора не зависит, следовательно, катализатор в одинаковой степени влияет на константу скоростей прямой и обратной реакций. Например, если константа скорости прямой реакции увеличилась в 100 раз, то и константа скорости обратной реакции должна увеличиться в 100 раз.
Т.о. введение катализатора позволяет добиваться наступления равновесия в более короткие сроки.
Рассмотренные зависимости скорости химических процессов и химического равновесия от условий протекания химических реакций позволяют регулировать процессы и сознательно выбирать условия их протекания в заданном направлении.
62
ТЕМА 6. Р А С Т В О Р Ы
6.1. Характеристика растворов
Растворы имеют важное значение в жизни и в практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.). В промышленности чаще имеют дело не с индивидуальными веществами, а со смесями двух и более веществ.
Самопроизвольное распределение одного вещества в другом в результате диффузии приводит к образованию растворов. Однако раствор нельзя рассматривать как смесь молекул различных веществ, так как свойства растворенного вещества и растворителя в общей системе раствора изменяются.
Например, объём раствора никогда не равен сумме объёмов растворителя и растворенного вещества. Образование растворов происходит в результате взаимодействия частиц растворителя и растворенного вещества с образованием комплексов переменного состава за счет действия межмолекулярных сил. Процесс образования раствора идет самопроизвольно даже в том случае, когда при растворении поглощается энергия, так как возрастание энтропии при растворении очень велико и обуславливает развитие необратимого процесса.
Взависимости от размера частиц смеси делятся на 3 группы:
1)Механические смеси: размер частиц больше 10-3 мм (взвеси – суспензии, эмульсии);
2)Коллоидные растворы: 10-4 – 10-6 мм ;
3)Истинные растворы: размер частиц равен размеру атомов, ионов, молекул
(5*10-6 мм или 5нм).
Первая и вторая группы являются гетерогенными системами, состоят из двух или более фаз с сильно развитой поверхностью раздела. Такие
63

системы получили название дисперсных систем. Они состоят из сплошной фазы, называемой дисперсионной средой, и прерывистой фазы (частиц),
называемой дисперсной фазой.
Истинные растворы представляют собой гомогенную смесь компонентов.
Вещества
Чистые |
|
Смеси |
|
|
|
Простые |
|
Сложные |
|
Гетерогенные |
|
Гомогенные |
|
|
|
|
|
|
(растворы) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Раствором называется газовая, твердая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Раствор состоит из растворенного вещества и растворителя, т. е.
среды, в которой эти вещества равномерно распределены в виде молекул и ионов. Растворитель сохраняет свое фазовое состояние при образовании раствора (водный раствор соли).
Компонент раствора, концентрация которого выше других компонентов, является растворителем, если оба компонента до растворения находились в одинаковом агрегатном состоянии. Например: раствор содержит 40% ацетона (растворенное вещество) и 60% бензола (растворитель).
64
6.1.1. Растворение и растворимость
Первой теорией растворения была физическая теория. Ее основоположники – Вант-Гофф, Аррениус. Они рассматривали растворение как физический процесс – диффузию. А растворы – это механические смеси растворителя и растворенных веществ.
Другая точка зрения на эти процессы – химическая теория. Ее основоположником был Д. И. Менделеев. Темой его диссертации было исследование системы вода-этиловый спирт. Именно им было обнаружено, что при их смешивании система приобретает новые свойства, которые наиболее ярко проявляются в соотношении 60:40 (уменьшение объема, тепловой эффект и т.д.)
Согласно химической теории растворение – это химический процесс взаимодействия растворителя и растворенных веществ. Растворы - это химические соединения растворителя и растворенных веществ.
Современная теория объединяет обе точки зрения и рассматривает растворение как физико-химический процесс. А растворы – это смеси переменного состава, в которых содержится растворитель, растворенное вещество и их соединения.
Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе.
По растворимости в воде все вещества делятся на 3 группы:
1)хорошо растворимые – 10 г вещества на 100 г воды;
2)малорастворимые – менее 1 г вещества на 100 г воды;
3)практически нерастворимые – менее 0, 01 г вещества на 100 г воды. Однако следует отметить, что абсолютно нерастворимых веществ нет .
Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде.
65
Растворимость зависит:
1.От природы растворителя.
2.От природы растворенного вещества.
3.От температуры (для жидкостей и твердых тел с повышением Т растворимость обычно увеличивается, для газов – уменьшается).
4.От давления (для газов растворимость обычно повышается с увеличением давления).
Однородность растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своей однородностью. Таким образом, растворы занимают промежуточное
положение между механическими смесями и химическими соединениями.
6.1.2. Классификация растворов
По агрегатному состоянию различают газовые, жидкие и твердые растворы (сплавы).
Газовые растворы. В газообразном состоянии частицы слабо взаимодействуют друг с другом, поэтому газовый раствор можно считать смесью компонентов. Пример: воздух.
66
Твердый раствор – смешанный кристалл, решетку которого образуют частицы двух или более веществ, размещённых друг относительно друга неупорядоченно.
Все кристаллические твердые тела способны образовывать твердые растворы в большинстве случаев с узкими пределами концентраций растворяющегося компонента. Однако известны системы с полной взаимной растворимостью. Например: Сu –Ag, Ag-Au.
Типы твердых растворов.
1. Растворы замещения – одни частицы в узлах кристаллической решетки замещаются другими, если кристаллические решетки компонентов однотипны, размеры частиц компонентов близки, химические свойства частиц схожи (серебро-золото).
2.Растворы внедрения образуются при проникновении меньших по размеру частиц в междоузлия решетки, образованной более крупными частицами (железо-углерод).
3.Растворы вычитания образуются только на основе химических соединений при недостатке одного из компонентов в соответствующей подрешетке (титан-кислород).
Сплавы представляют собой смеси двух или более индивидуальных металлов, их получают совместным нагреванием компонентов до полного расплавления смеси. В сплавах могут присутствовать в небольших количествах некоторые металлы (C, Si, S)
Жидкие растворы – растворы газов, жидкостей и твердых тел в жидких растворителях.
В зависимости от природы растворителя различают водные и
неводные растворы.
По наличию или отсутствию электролитической диссоциации растворенного вещества на ионы различают растворы электролитов и
растворы неэлектролитов.
67
6.1.3.Процесс диссоциации
Взависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному.
Наиболее типичны при этом два случая:
1.Диссоциация растворяющихся солей, т.е. кристаллов с ионной структурой
2.Диссоциация при растворении кислот, т.е. веществ,
состоящих из полярных молекул.
Рассмотрим первый случай. Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам – положительными (рис.6.1). Но, если ионы притягивают к себе молекулы воды, то и молекулы воды с такой же силой притягивают к себе ионы. В то же время притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. При этом, как показано на рисунке, образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
Иначе протекает диссоциация полярных молекул (рис.6.2). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов – поляризуют молекулу. Такая поляризация в сочетании с колебательными тепловыми
68
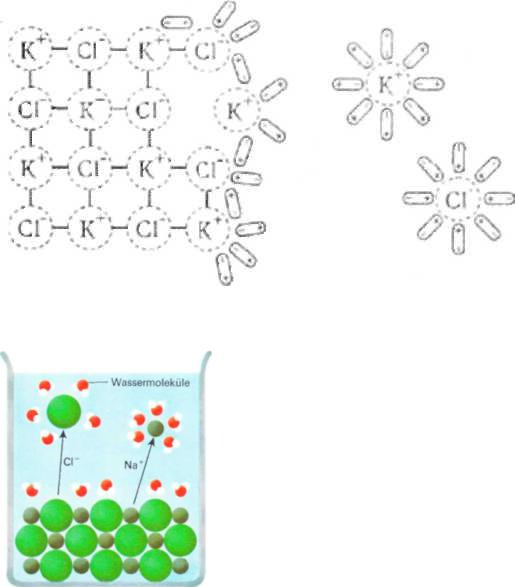
Рис. 6.1. Схема растворения соли.
движениями атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул воды, приводит в конечном счете к распаду полярной молекулы на ионы. Эти ионы гидратируются. При этом ион водорода Н+ оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода происходит процесс, который схематично можно выразить уравнением:
Н2О + НСl = Н3О+ + Cl─
Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов.
69
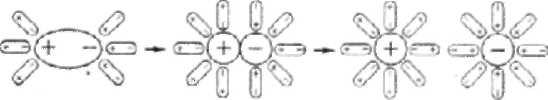
Рис. 6.2. Схема диссоциации полярных молекул в растворе.
6.1.4. Способы выражения состава растворов
Важнейшей характеристикой всякого раствора является концентрация.
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Рассмотрим наиболее употребительные в химической практике величины, выражающие содержание растворенного вещества в растворе.
Массовая доля (ω) или процентная концентрация. Это процентное отношение массы растворенного вещества к общей массе раствора.
ω = (mв-ва/mр-ра)•100%
Например, ω = 10 %. Это значит, что в 100 г раствора содержится 10 г вещества.
Молярная концентрация или молярность (СA или М) показывает количество растворенного вещества A (n = m/M ) в 1 литре раствора (V). Например: 1,5 М раствор или СA =1,5 моль/л. Это означает, что 1,5 моль какого-либо вещества A растворено в 1 литре раствора.
СA = n/V = mв-ва /M*Vр-ра, где М – молярная масса вещества.
Молярная концентрация эквивалентов или нормальность (СN или
Н ) показывает число эквивалентов растворенного вещества (nЭ = m/MЭ) в 1
70
