
andruhova
.pdfцинка уходят из двойного слоя в объем раствора, а электроны, перешедшие на медный электрод, восстанавливают ионы меди.
Следовательно, в процессе работы элемента происходит растворение цинкового электрода и осаждение меди из раствора на медном электроде. Чтобы элемент работал, цепь должна быть замкнутой, т.е. между растворами должен быть электрический контакт. Перенос тока внутри элемента осуществляется ионами. Суммарная реакция в элементе складывается из двух пространственно разделенных электродных процессов.
Итак, при работе элемента Даниэля-Якоби протекают следующие процессы:
1. Реакция окисления цинка Zn0 – 2е → Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами.
2. Реакция восстановления меди Cu2+ + 2е → Cu0.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами.
3.Движение электронов во внешней цепи.
4.Движение ионов в растворе: анионов SO42– к аноду, катионов
(Cu2+, Zn2+) к катоду.
Суммируя электродные реакции, получаем Zn + Cu2+ = Zn2+ + Cu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
При схематической записи, заменяющей рисунок гальванического элемента, границу раздела между проводниками 1-го и 2-го рода обозначают
151

одной вертикальной чертой, а границу раздела между проводниками 2-го рода – двумя чертами. Анод на схеме указывают слева, а катод – справа.
Схема элемента Даниеля-Якоби, например, записывается в виде:

 е
е 
А (–) Zn|ZnSO4||CuSO4|Cu (+) К
(–) A: Zn0 – 2e → Zn2+ – окисление;
(+) K: Cu2+ + 2e → Cu0 – восстановление; Zn0 + Cu2+ → Zn2+ + Cu0.
Данная окислительно-восстановительная реакция лежит в основе работы гальванического элемента.
Как видно из схемы гальванического элемента, внутри идет химическая реакция , а во внешней цепи элемента протекает электрический ток, т.е. в
гальваническом элементе происходит превращение химической энергии в электрическую. При помощи гальванического элемента можно совершить электрическую работу за счет энергии химической реакции.
9.2.1. Стандартные электродные потенциалы
Чтобы дать количественную характеристику химической активности какого-либо металла, надо построить гальванический элемент из стандартного водородного электрода и измеряемого металла, погруженного в раствор своей соли с концентрацией металла 1 моль/л.
Разность потенциалов между стандартным водородным электродом и стандартным металлическим электродом называется стандартным электродным потенциалом (φ0 или Е0).
Стандартный электродный потенциал металла ЕМе0 считают
отрицательным, если в паре металлический электрод – водородный электрод, на металле происходит процесс окисления :
А (–) Zn |Zn2+ || 2H+ | (H2) Pt (+) К
152

(–) A: Zn0 – 2e → Zn2+ – окисление;
(+) K: 2Н+ + 2e → Н20 – восстановление; 2Н+ + Zn0→Н20 + Zn2+
Стандартный электродный потенциал металла ЕМе0 считают
положительным, если в паре металлический электрод – водородный электрод, на металле происходит процесс восстановления
А(–) Pt(H2)|2H+||Cu2+|Cu (+) К
(–)A: Н20 – 2e → 2Н+ – окисление;
(+) K: Cu2+ + 2e → Cu0 – восстановление; Н20 + Cu2+ → 2Н+ + Cu0
По химической активности металлы располагают в определенный ряд в порядке возрастания их стандартных электродных потенциалов, называемый рядом стандартных электродных потенциалов металлов или рядом напряжений. В отличие от периодической системы элементов этот ряд не является отражением общей закономерности, на основе которой можно давать разностороннюю характеристику химических свойств металлов.
Ряд напряжений характеризует лишь окислительно-восстановительную способность электрической системы «металл – ион металла» в строго определенных условиях.
В основных чертах он имеет следующий вид:
K, Ca, Na, Mg, Al, Ti, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Ниже приведены основные следствия из ряда напряжений:
1.Чем левее расположен металл в ряду напряжений, тем сильнее его восстановительная способность и тем слабее окислительная способность его иона в растворе (т.е. тем легче он отдает электроны (окисляется) и тем труднее его ионы присоединяют обратно электроны).
153

2.Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
3.Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют.
4.Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
9.2.2. Электродвижущая сила (ЭДС) гальванического элемента
Электродвижущая сила (ЭДС) – максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента. Она равна разности равновесных потенциалов электродов:
ЭДС = ЕЭ = ЕК – ЕА > 0
ЭДС характеризует способность электронов к движению во внешней
цепи.
Если условия стандартные, то ЭДС элемента Даниэля –Якоби будет равным:
ЭДС = Е0К – Е0А = Е0 Cu2+|Cu − E 0 Zn2+|Zn = 0,34 −(−0,76) =1,18В
Чем больше отличаются металлы по величине электродного потенциала Е, тем больше ЭДС гальванического элемента, построенного из этих металлов.
Электродный потенциал зависит от свойств металла, концентрации его ионов в растворе и температуры.
Для нестандартных условий электродный потенциал вычисляется по формуле Нернста:
EMen +|Me = E 0 Men+|Me + RTnF ln[Men+ ] ,
где EMen+|Me – равновесный электродный потенциал, В;
154

E 0 Men+|Me – стандартный электродный потенциал, В; n – степень окисления металла;
R – универсальная газовая постоянная, R = 8,31 Дж/моль К; F – число Фарадея, F = 96500 Кл;
[Men+] – концентрация ионов металла в растворе, моль/л.
Если подставить в данную формулу значения R, F, T = 298 K и перевести натуральный логарифм в десятичный, то получится упрощенная формула Нернста:
EMen+|Me = E 0 Men+|Me + 0,059n lg[Men+ ] .
9.2.3. Концентрационный гальванический элемент
Можно составить гальванический элемент, соединив два электрода из одинакового металла, если концентрация их солей различна. Такой тип элемента называется концентрационным.
В основе работы такого элемента лежит стремление к самопроизвольному выравниванию концентраций. Электроны переносятся от электрода с более разбавленным раствором соли (анод) к электроду с более концентрированным раствором (катод).
А (-) Zn|ZnSO4||ZnSO4|Zn (+) K 0,01 моль/л 0,1 моль/л
А: Zn0 – 2e → Zn2+ (0,01 моль/л) K: Zn2+ + 2e → Zn0 (0,1 моль/л)
Из этой схемы следует, что перенос электронов сопровождается самопроизвольными реакциями, т.е. возрастанием концентрации Zn2+ в сосуде с меньшей концентрацией и уменьшением концентрации ионов цинка в сосуде с более концентрированным раствором. Перенос электронов происходит до тех пор, пока не сравняются концентрации.
Можно вычислить ЭДС этого гальванического элемента:
155
ЭДС = ЕЭ = ЕК – ЕА. Так как концентрации ионов цинка в растворе отличаются от стандартных, необходимо значения электродных потенциалов рассчитать по формуле Нернста:
E |
|
n+ |
|
= E 0 Men+|Me + |
0,059 |
lg[Men+ ] |
||||
Me |
|Me |
|
|
|
||||||
|
|
|
|
|
|
|
n |
|||
|
|
|
|
|
|
|
|
|
||
EК |
= E 0 Zn2+|Zn + |
|
0,059 |
lg 0,01 = −0,76 −0,059 = −0,819В |
||||||
|
|
|
||||||||
|
|
|
|
|
|
n |
||||
EА |
= E 0 Zn2+|Zn + |
0,059 |
lg 0,1 = −0,76 −0,29 = −0,789В |
|||||||
|
||||||||||
|
|
|
|
|
|
n |
||||
ЭДС = ЕК – ЕА= – 0,789 – (– 0,819) = 0,03 В
156
ТЕМА 10. ЭЛЕКТРОЛИЗ
10.1. Сущность электролиза
Если в электролит поместить электроды, поляризованные от внешнего источника тока, то под действием электрического тока ионы электролита приобретают направленное движение и на электродах будут протекать следующие реакции:
1. Восстановление катионов (катодный процесс) на отрицательном электроде (на катоде), на который поступают электроны от внешнего источника тока:
Кn+ + ne → К0
2. Окисление анионов (анодный процесс) на положительном электроде (на аноде), с которого электроны идут во внешнюю цепь:
An─ - ne → А0
Т. е. происходит окислительно-восстановительный процесс. Электрическая энергия превращается в химическую.
Электролиз – это окислительно-восстановительный процесс, протекающий на границе «электрод-электролит» при прохождении электрического тока через раствор или расплав электролита.
На результат электролиза влияет:
1.Природа электролита (растворы; расплавы)
2.Природа электрода ((нерастворимые (С, Pt); растворимые (металлы))
Рассмотрим влияние природы электролита на процесс
электролиза
10.2. Электролиз расплавов солей
Рассмотрим электролиз расплава хлорида натрия (NaCl плавится при 8010 С). Если в расплав погрузить инертные (угольные) электроды и
157

пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Na+ – к катоду, анионы Cl– – к аноду (рис. 10.1).
|
NaCl |
Na+ + Cl– |
( – ) катод |
Na+ Cl– |
анод ( + ) |
Ионы натрия Na+, достигнув катода, принимают от него электроны и восстанавливаются:
Na+ + e– = Na
а хлорид–ионы Cl–, отдав электроны аноду, окисляются: 2Cl– – 2e– = Cl2.
В итоге на катоде выделяется металлический натрий, а на аноде хлор. Если теперь сложить уравнения этих двух электродных реакций (предварительно умножив первое на 2, то получим общее, или суммарное
уравнение электролиза хлорида натрия:
Na+ + e– = Na |
|
2 |
|
||
2Cl– – 2e– = Cl2 |
|
1 |
|
––––––––––––––––––––––––––––––––––––––––––
2Na+ + 2Cl– → 2Na + Cl2 или 2NaCl → 2Na + Cl2
Прибор, в котором проводят электролиз, называют электролизером или электролитической ванной.
электроны
+
|
|
|
|
|
|
– |
|
|
|
|
– катод |
|
|||
|
|
|
|||||
анод + |
|
|
|||||
|
|
|
|
||||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Na+
Cl–
Рис.10.1. Схема электролиза расплава NaCl
158

10.3. Электролиз растворов солей
КАТОДНЫЕ ПРОЦЕССЫ
В растворе кроме ионов соли Кn+ и An─ имеются еще ионы воды Н+ и ОН─, благодаря диссоциации молекул воды Н2О 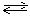 Н+ + ОН─.
Н+ + ОН─.
Для того, чтобы осуществить процесс восстановления катиона металла или иона водорода, необходимо сместить значение равновесного потенциала электрода, поляризовать катод отрицательно, т.е. приложить от внешнего источника тока потенциал, достаточный для осуществления процесса.
Выделительный потенциал – величина поляризации электрода, при которой возможен тот или иной процесс.
Men+ + ne → Me0
2H2O + 2e → H2 + 2OH─
Выделительный потенциал металла зависит от природы металла: чем активнее металл, тем нужна большая отрицательная поляризация электрода, тем труднее он выделяется. Используя ряд активности металлов, можно сказать, что «выделительный потенциал» увеличивается в обратном порядке.
легкость разряда катионов возрастает
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H , Sb, Bi,
Cu, Hg, Ag, Pd, Pt, Au
По своей активности металлы делятся на три группы:
1.Активные – металлы, стоящие в ряду стандартных электродных потенциалов левее алюминия Li – Al.
2.Металлы средней активности – металлы, стоящие в ряду стандартных электродных потенциалов между алюминием и водородом Ti – Н.
3.Малоактивные металлы – металлы, стоящие в ряду стандартных электродных потенциалов после водорода.
Катодные процессы при электролизе водных растворов солей в зависимости от природы катиона металла:
159
1. Если катионом электролита является малоактивный металл, происходит восстановление катиона металла:
Men+ + ne → Me0
2.Если катионом электролита является активный металл, происходит восстановление водорода:
2H+ + 2e → H2↑ — кислая среда
2H2O + 2e → H2 + 2OH─ — нейтральная среда
3.Если катионом электролита является металл средней активности, то
взависимости от концентрации и от условий электролиза происходит
восстановление металла и водорода одновременно:
Men+ + ne → Me0
2H+ + 2e → H2↑ — кислая среда
2H2O + 2e → H2 + 2OH─— нейтральная среда
Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла. Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться катионы серебра (Е0 = + 0,80 В), затем катионы меди (Е0 = + 0,34 В) и последними – катионы железа (Е0 = – 0,44 В).
Порядок восстановления катионов из водных растворов солей:
1.В первую очередь восстанавливаются катионы малоактивных металлов.
2.Во вторую очередь восстанавливаются катионы металлов средней активности.
3.В последнюю очередь восстанавливается водород
160
