
andruhova
.pdf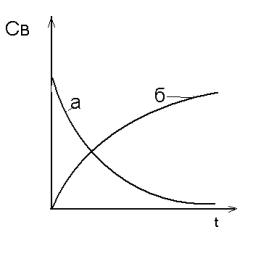
Рис. 4.1. Изменение концентрации исходного вещества (а) и продукта реакции (б) со временем.
Скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Концентрацию обычно выражают в (моль/л), а время в секундах,
следовательно, единицами измерения υср являются моль/л·с. Так как, в
общем случае концентрации реагентов непрерывно изменяется, то следует говорить о мгновенной скорости реакции, т.е. о ее скорости в данный момент времени: υ= dc/dt.
По физическому смыслу первая производная от концентрации по времени является тангенсом угла наклона касательной, проведенной к кривой СВ = f(t) в точке с текущими значениями координат СВ и t. Проводя такие касательные в точках, например, кривой (б) (Рис. 4.1), отвечающих различным моментам времени от начала химической реакции, и измеряя тангенс угла наклона касательных, получаем, что скорость химической реакции v = tgα со временем уменьшается (Рис. 4.2).
41
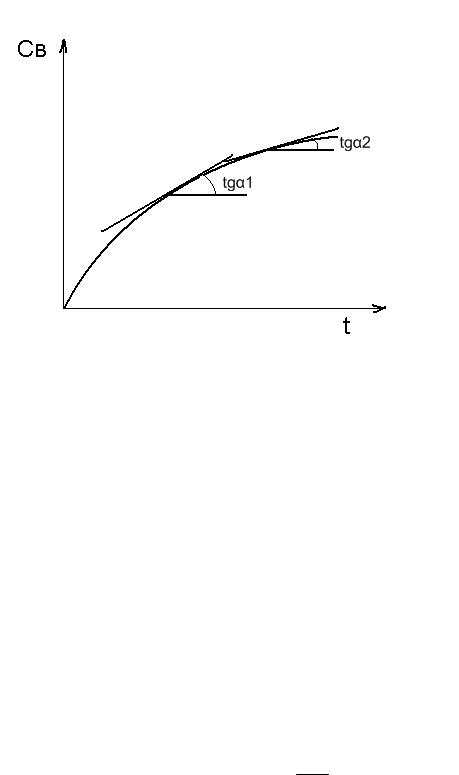
Рис. 4.2. Графическое определение скорости химической реакции: tgα1 > tgα2;
υ1 > υ2.
Иногда на практике применяется т.н. относительная скорость υотн.= 1/t.
Многие химические процессы, имеющие большое значение в технике, относятся к числу гетерогенных реакций: горение жидкого и твердого топлива С(тв) + О2(г) = СО2(г) ; химическая и электрохимическая коррозия металлов и сплавов. В таких реакциях поверхность раздела фаз является реакционным пространством и скорость измеряется изменением
поверхностной концентрации одного из веществ, участвующих в реакции, за единицу времени на единицу реакционной поверхности.
νгет = S nt ,
где n – число молей,
S – площадь поверхности раздела фаз.
Любые гетерогенные процессы связаны с переносом вещества, и в них можно выделить три стадии:
42
1.Подвод реагирующего вещества из объема к реакционной поверхности.
2.Химическая реакция на поверхности раздела фаз.
3.Отвод продукта реакции от поверхности раздела фаз.
Первая и последняя стадия осуществляется за счет диффузии. Во многих случаях химическая реакция могла бы протекать очень быстро, если подвод реагирующего вещества к поверхности и отвод продуктов от нее тоже происходили бы достаточно быстро. Такие процессы называются диффузионно контролируемыми, т.к. скорость определяется скоростью переноса вещества (диффузией). Для ускорения таких реакций обычно используют перемешивание. Если химическая реакция (вторая стадия) имеет высокую энергию активации, то эта стадия оказывается самой медленной, и процесс не ускоряется при перемешивании. Такие гетерогенные реакции называются кинетически контролируемыми. Для их ускорения необходимо повысить температуру.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. Для диффузионно контролируемых процессов такой стадией является перенос вещества (1-я или 3-я стадии), а кинетически контролируемые процессы лимитируются 2-й стадией.
Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы.
Скорость химической реакции зависит от многих факторов: природы и концентрации реагентов, давления (для реакций с участием газов), температуры, катализатора, наличия примесей и их концентрации, от степени измельчения, от среды.
43
4.2. Влияние концентрации на скорость химических реакций. Закон действующих масс (ЗДМ)
Чтобы прореагировать, частицы должны столкнуться, причем эффективно. Обычно число столкновений, приводящих к реакции, возрастает с повышением концентраций реагентов.
Зависимость скорости химической реакции от концентраций выражается законом действующих масс (Гульберг и Вааге – 1867г. и независимо от них Бекетов):
Скорость химических реакций пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов в единицу времени при постоянной температуре.
Для гомогенных реакций: nA + mB = AnBm; ЗДМ выражается следующим образом:
υ= k · [A]n[B]m, где k – константа скорости реакции.
Величина k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентрации веществ.
Физический смысл k – если [А] = [В] = 1 моль/л, то k =υ, т.е. k – это
скорость в момент, когда концентрации реагирующих веществ равны единице.
Для гетерогенных реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация веществ, находящихся в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для реакции горения угля: С(тв) + О2(г) = СО2(г) закон действующих масс запишется так:
υ= k´·const·[О2] = k ·[О2], где k = k´·const.
44
4.3. Влияние давления на скорость химической реакции
Если реакция протекает в газовой фазе, то изменение давления существенно влияет на скорость химической реакции.
Например: если увеличить давление в системе в 2 раза, объем уменьшится в 2 раза, концентрация веществ увеличится в 2 раза, что приведет к увеличению скорости реакции в соответствие с ЗДМ.
4.4. Влияние температуры на скорость химической реакции
Скорость химических реакций в подавляющем большинстве случаев с нагреванием возрастает, причём она очень чувствительна к изменению температуры. Так, для осуществления синтеза Н2О из Н2 и О2 при 20 0С необходимо 54 млрд. лет. При 500 0С для этого требуется всего 50 мин., а при 700 0С реакция идет со скоростью взрыва(1·10-6с).
Эту зависимость описывает приближенное правило Вант–Гоффа
(1884г.): При увеличении температуры на каждые 100С скорость гомогенной реакции возрастает в 2 – 4 раза:
νt |
|
|
=νt γ |
t2−t1 |
|
2 |
|
10 |
|||
|
|
|
1 |
|
|
|
|
|
νt 2 |
t |
|
|
|
|
= γ 10 |
|
|
|
|
νt1 |
|
||
|
|
|
|
|
|
где υt2, υt1 – скорости при соответствующих температурах t2 и t1,
γ – температурный коэффициент, равный 2, 3,…7, чаще всего 2 < γ < 4 –
это число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры реагирующих веществ на 100С.
45
При концентрации реагирующих веществ 1 моль/л, скорость химической реакции численно равна константе скорости υ = k,
следовательно, можно записать:
t
kТ2 = kТ1 · γ 10
Это уравнение показывает, что k зависит от температуры так же, как и скорость процесса.
Уравнение Вант–Гоффа лишь приближенно оценивает зависимости υ = f(Т) и k = f(Т). Функциональную зависимость k = f(Т) установил шведский ученный С. Аррениус (1989г.):
k =A · е –
где А – предэкспоненциальный множитель, по физическому смыслу отражающий вероятность благоприятных для осуществления реакции взаимных ориентаций активных молекул при соударении;
Ea- энергия активации реакции; Т – абсолютная температура, К.
Из этого уравнения следует, что k зависит от температуры и энергии активации.
4.5. Зависимость скорости реакции от природы реагирующих веществ. Энергия активации
Что такое энергия активации Еа и почему она влияет на скорость химической реакции?
Необходимым условием начала химического взаимодействия между двумя молекулами должно быть их соударение. Однако не все соударения молекул заканчиваются актом химического взаимодействия, т.е. не все соударения эффективны. Доля эффективных соударений, как правило, незначительна. Если воспользоваться результатами подсчёта числа
46
столкновений между молекулами, то количество столкновений окажется настолько большим, что все реакции должны протекать мгновенно. Это противоречие можно объяснить тем, что в реакцию вступают лишь молекулы, обладающие необходимой энергией.
Если кинетическая энергия сталкивающихся молекул достаточна для ослабления связей между атомами, то образуются новые молекулы.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Её значение лежит в пределах 40-400 кДж/моль. Молекулы, обладающие такой энергией, называются активными. Они достигли определенного энергетического уровня, характерного для данной реакции, ее энергетического предела. Эти молекулы находятся в особом состоянии, которое принято называть п е р е х о д н ы м или состоянием активированного комплекса (АК). Эта система характеризуется тем, что в ней уже нет исходных веществ, но нет еще и продуктов реакции. Например, ход реакции АВ + СД = АД + СВ можно представить схемой:
A |
|
B |
A |
B |
A |
B |
|
|
|||||||
+ |
→ |
|
|
→ |
|
|
|
D |
|
C |
D |
C |
D |
|
C |
|
|
||||||
Исходные |
|
Активированный |
Продукты |
||||
Молекулы |
|
комплекс |
|
реакции |
|||
В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования АК невелико, порядка 10-13 с. Энергия системы в переходном состоянии max, а это значит, что АК крайне неустойчив и по ходу реакции он превращается в продукты реакции.
47
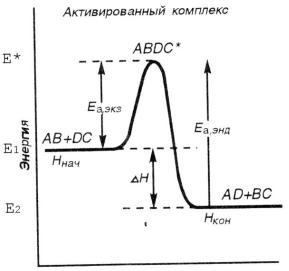
Рис. 4.3. Энергетическая диаграмма хода реакции с образованием активированного комплекса
Е1 – средний уровень энергии молекул исходных веществ,
Е2 - средний уровень энергии молекул продуктов реакции, Е* - средняя энергия активированного комплекса, Е* - Е1 = Еа Е2 <Е1 ; ∆Н < 0 – процесс экзотермичен,
Е2 >Е1 ; ∆Н > 0 – процесс эндотермичен, Е2 ─Е1 = ∆Н
Доля активных молекул в системе зависит от температуры. С увеличением температуры растет доля молекул, энергия которых равна или выше энергии активации Еа, соответственно растет доля молекул, способных к активным столкновениям с образованием АК, т.е. происходит ускорение реакции. Чем выше энергия активации, тем очевидно, меньше доля частиц, способных к активному взаимодействию. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические. Высокий энергетический барьер является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя и принципиально возможны (∆G < 0). Так, в обычных условиях самопроизвольно не загораются: дерево, ткани, бумага, уголь, хлеб, керосин, хотя энергия Гиббса реакций окисления этих веществ ниже нуля.
48
1.Если Еа мала < 40 кДж/моль, то это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Примером могут служить реакции ионного обмена. Такие реакции протекают практически мгновенно.
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
2.Напротив, если энергия активации реакции очень велика (больше 120 кДж/моль), то это означает, что лишь очень малая часть столкновений взаимодействующих частиц приводит к протеканию химической реакции. Скорость подобной реакции очень мала. Примером реакции, имеющей высокую энергию активации, является реакция синтеза аммиака:
N2 + 3H2 = 2NH3.
Эта реакция при обычных температурах протекает столь медленно, что заметить ее протекание практически невозможно.
3.Наконец, если энергия активации реакции не очень мала и не очень велика (40-120 кДж/моль), то такая реакция будет протекать не очень быстро и не очень медленно. Скорость такой реакции можно измерить. Примером реакции, протекающей с измеримой скоростью, может служить приведённая выше реакция разрушения тиосульфата натрия серной кислотой.
Энергия активации Еа – это энергия, необходимая для перехода частиц в состояние активированного комплекса, это один из основных параметров, который характеризует скорость химического взаимодействия.
Еа зависит от природы реагирующих веществ. Чем больше энергия активации (при прочих равных условиях), тем меньше скорость реакций. Энергия активации необходима для ослабления химических связей в исходных веществах и для преодоления отталкивания между электронами,
49
которое возникает при сближении молекул и атомов взаимодействующих веществ и мешает их столкновению.
4.6. Влияние катализатора на скорость химической реакции
Катализ – метод изменения скорости реакции.
Катализатор – это вещество, изменяющее скорость термодинамически возможной реакции.
Катализатор не расходуется в процессе протекания реакции. Реакции, протекающие под действием катализаторов, называются каталитическими. Обычно катализаторами называют вещества, увеличивающие скорость реакции (положительный катализ), а ингибиторами – вещества, замедляющие протекание реакции (отрицательный катализ).
Кроме способности ускорять реакции, многие катализаторы обладают селективностью (избирательностью). Под влиянием катализаторов реакции могут протекать избирательно, т.е. с увеличением выхода определенных продуктов. Например, этанол в присутствии оксидов алюминия и тория разлагается на этилен и воду:
Al2O3,ThO2
C2H5OH  C2H4 + H2O
C2H4 + H2O
Ав присутствии никеля, железа, серебра или меди – на ацетальдегид
иводород:
Ag, Cu
C2H5OH  CH3COH + H2
CH3COH + H2
Каталитическая активность, т.е. способность ускорения реакции, многих катализаторов возрастает при добавлении небольших количеств некоторых веществ, называемых промоторами, которые без катализатора могут быть каталитически неактивными. Например, скорость окисления SO2
50
