
andruhova
.pdfОбе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом ЛеШателье оба равновесия смещаются вправо, и гидролиз протекает полностью
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl.
Это называется взаимным усилением гидролиза.
91
ТЕМА 7. СТРОЕНИЕ АТОМА
7.1. Модели строения атома
Примерно до конца XIX века атом рассматривался как мельчайшая неделимая частица материи и не являлся предметом изучения. В конце XIX и начале XX веков появились экспериментальные доказательства сложной структуры атома: фотоэффект – явление, когда при освещении металлов с их поверхности испускаются носители электрического заряда; катодные лучи
– поток отрицательно заряженных частиц – электронов в вакуумированной трубке, содержащей катод и анод; рентгеновские лучи – электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей; радиоактивность – явление самопроизвольного превращения одного химического элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения; а также открытие Томсоном электрона (частица, имеющая наименьший отрицательный заряд в природе, с массой
9,1095 *10-28г., диаметром 10-12 – 10-13см.).
Таким образом, было установлено, что атомы состоят из отрицательно и положительно заряженных частиц, сильно взаимодействующих между собой. Возник вопрос, как же устроен атом?
Первоначально были предложены две модели атома.
Согласно модели Томсона (1903 г.), атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда. Для проверки гипотезы Томсона Резерфорд провел опыты по рассеиванию α-частиц металлическими пластинками. Эти опыты показали, что основная доля α-частиц проходила через пластинки беспрепятственно, т.е. подавляющая часть пространства,
92
занимаемого атомом, является “пустой”, а почти вся его масса занимает очень малую долю объема.
Резерфордом в 1911 г. была предложена планетарная модель атома.
Согласно этой модели, атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов.
Эта модель первоначально не могла объяснить устойчивость атома, т.к. электрон, вращающийся вокруг положительно заряженного ядра, должен, подобно колеблющемуся электрическому заряду, испускать электромагнитную энергию в виде световых волн. Но излучая свет, электрон теряет часть своей энергии, что приводит к нарушению равновесия между центробежной силой, связанной с вращением электрона, и силой электростатического притяжения электрона к ядру. Таким образом, электрон, непрерывно излучая электромагнитную энергию и двигаясь по спирали, будет приближаться к ядру. Исчерпав всю свою энергию, он должен “упасть” на ядро, и атом прекратит свое существование. Этот вывод противоречит реальным свойствам атомов, которые представляют собой устойчивые образования, и могут существовать, не разрушаясь, чрезвычайно долго.
Вторым противоречием этой модели была невозможность объяснить линейчатый характер атомных спектров, т.е. излучение атомом электромагнитных волн только с определенными длинами волн. Если электрон, вращаясь вокруг ядра и приближаясь к нему, непрерывно меняет свою скорость, тогда частота испускаемого им света определяется частотой его вращения, и следовательно должна непрерывно меняться. Это означает, что спектр излучения атома должен быть непрерывным, сплошным.
Для устранения этих противоречий Бор в 1913г. дополнил планетарную модель атома теорией квантов Планка (лучистая энергия излучается не непрерывно, а дискретно, т.е. определенными порциями – квантами Е =h·ν) на основе следующих предположений.
93
Постулаты Бора:
1)Электрон может вращаться вокруг ядра не по любым орбитам, а лишь по некоторым определенным (стационарным) орбитам, на которых он не излучает энергии.
2)Ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. При сообщении энергии извне электрон может перейти на одну из более удаленных орбит (возбужденное состояние атома).
3)Поглощение и излучение энергии атомом может происходить только при переходе электрона с одной орбиты на другую. При этом разность энергий начального и конечного состояний воспринимается или отдается в виде кванта лучистой энергии. Этому излучению соответствует частота колебаний ν, выражаемая уравнением Планка:
hν = Eн – Eк ,
где h – постоянная Планка (h=6,62 10–34 Дж с); Ен, Ек – соответственно энергии начального и конечного состояний.
Исходя из этих представлений, были вычислены радиусы стационарных орбит. Они относятся друг к другу как квадраты натуральных чисел 12:22:32:…:n2. Величина n (порядковый номер орбиты, или номер энергетического уровня) была названа главным квантовым числом. Для атома водорода радиус ближайшей к ядру орбиты равен 52,9 10–12 м. Электрон вращается по ней со скоростью 2200 км/ч.
7.2.Квантово-механическая модель строения атома
7.2.1.Двойственная природа электрона
В1920 г. Резерфорд ввел понятие о протоне (ядро водорода) как о положительно заряженной элементарной частице, входящей в состав ядра любого атома, и предсказал существование нейтрона в составе ядра, не
94
имеющего электрического заряда. Было установлено, что ядра имеют
положительный заряд и состоят из протонов и нейтронов.
Для того, чтобы объяснить, почему имеет место квантование энергетических уровней (существование стационарных орбит), в 1924 г. де Бройлем была выдвинута гипотеза, что каждая движущаяся частица одновременно обладает свойствами волны, длина которой λ = h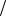 mυ . Эта гипотеза основывалась на последних достижениях физики того времени (например, было уже известно, что свет имеет двойственную природу, обладая свойствами электромагнитной волны и одновременно свойствами потока частиц – фотонов). Т.е. электрону присуща корпускулярноволновая двойственность (дуализм).
mυ . Эта гипотеза основывалась на последних достижениях физики того времени (например, было уже известно, что свет имеет двойственную природу, обладая свойствами электромагнитной волны и одновременно свойствами потока частиц – фотонов). Т.е. электрону присуща корпускулярноволновая двойственность (дуализм).
Корпускулярные свойства электрона выражаются в его способности проявлять свое действие только как целого, электроны как частицы производят давление.
Волновые свойства электрона проявляются в особенностях его движения, в дифракции и интерференции электронов. Гипотеза де Бройля экспериментально подтверждается дифракцией электронов в кристаллах и позволяет объяснить существование стационарных орбит. Электрон может без потери энергии находиться на тех орбитах, в которых укладывается целое число волн де Бройля. В этом случае соблюдается условие существования стоячей волны.
Согласно классической механике, движение материальной точки однозначно описывается значениями координат и импульса. В случае микрообъектов описать координаты и скорость с любой точностью принципиально невозможно. Гейзенберг установил (1927г.) принцип
неопределенности: невозможно одновременно точно определить положение микрочастицы (ее координаты) и ее количество движения.
Математическое выражение принципа неопределенности имеет вид:
95
х р ≥ |
h |
или |
x υ ≥ |
h |
, |
|
2π |
2πm |
|||||
|
|
|
|
Где ∆х, ∆р, ∆υ – соответственно неопределенности в положении, импульсе и скорости частицы. Из этого соотношения следует, что чем точнее определена координата частицы (чем меньше неопределенность ∆х), тем менее определенной становится скорость (больше ∆υ). И наоборот, чем точнее известен импульс (скорость), тем более неопределенно местоположение частицы. Для примера допустим, что положение электрона определено с точностью 0,001 нм = 0,001 10–9 м. Тогда неопределенность в скорости его движения составит огромную величину 58000 км/с.
7.2.2. Волновое уравнение
Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его движения. В связи с этим в квантовой механике состояние микрочастицы полностью описывается не ее координатой и скоростью, а некоторой функцией, которая носит вероятностный характер.
Согласно квантовой механике, движение электрона в атоме описывается волновым уравнением (уравнение Шредингера):
|
h2 |
|
∂ 2Ψ |
|
∂ 2 |
Ψ |
|
∂ 2 |
Ψ |
|
, |
|
− |
|
|
|
+ |
|
|
+ |
|
|
|
+UΨ = EΨ |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
∂y 2 |
|
∂z2 |
|
|
|
||
|
8π 2 m ∂x 2 |
|
|
|
|
|
||||||
где Ψ – волновая функция («пси»); m – масса электрона;
U – потенциальная энергия;
E – полная энергия электрона; x, y, z – координаты.
Решением уравнения Шредингера является волновая функция Ψ и
соответствующее ей значение энергии электрона E. Функция Ψ носит
вероятностный характер, описывает состояние электрона в атоме или
96

молекуле и является обычной математической функцией. Её называют волновой функцией или орбиталью. Волновая функция, подобно амплитуде любого волнового процесса, может принимать как положительные, так и отрицательные значения. Величина ψ2 всегда положительна и обладает очень важным свойством: чем больше ее значение в данной области пространства, тем выше вероятность того, что электрон проявит здесь свое действие, т.е. что его существование будет обнаружено в каком-либо физическом процессе. Более точным будет следующее утверждение: вероятность обнаружения электрона в некотором малом объеме ∆V выражается произведением ψ2∆V. Таким образом, сама величина ψ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства.
Для уяснения физического смысла квадрата волновой функции рассмотрим рисунок, на котором изображен некоторый объем вблизи ядра атома водорода.
Рис. 7.1. Электронное облако атома водорода
Плотность размещения точек на рисунке пропорционально значению ψ2 в соответствующей области пространства: чем больше величина ψ2, тем гуще расположены точки. Если бы электрон обладал свойствами материальной точки, то рисунок можно было бы получить, многократно наблюдая атом водорода и каждый раз отмечая местонахождение электрона; плотность размещения точек на рисунке была бы тем больше, чем чаще обнаруживался бы электрон в соответствующей области пространства или, иначе говоря, чем больше вероятность обнаружения его в этой области.
97

Однако представление об электроне как о материальной точке не соответствует его истинной физической природе. Поэтому рисунок правильнее рассматривать как схематическое изображение электрона, «размазанного» по всему объему атома в виде так называемого электронного облака: чем плотнее расположены точки в том или ином месте, тем больше здесь плотность электронного облака. Иначе говоря, плотность электронного облака пропорциональна квадрату волновой функции. Следует иметь в виду, что электронное облако не имеет определенных, резко очерченных границ: даже на большом расстоянии от ядра существует некоторая, хотя и очень малая, вероятность обнаружения электрона. Поэтому, под электронным
облаком понимают область пространства вблизи ядра атома, в которой сосредоточена преобладающая часть (90%) заряда и массы электрона.
Следствием решения уравнения Шредингера являются квантовые числа, характеризующие поведение электрона в атоме. Эти квантовые числа однозначно характеризуют состояние электронов любого атома.
7.3. Квантовые числа
1. Главное квантовое число (n) определяет средний радиус электронного облака, или общую энергию электрона на данном уровне. Оно принимает натуральные значения от 1 до ∞. В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
2. Побочное, или орбитальное, квантовое число (l) определяет форму электронного облака. Энергия электронов в пределах энергетического уровня расщепляется на энергетические подуровни.
98
Орбитальное квантовое число l может принимать в пределах каждого уровня целочисленные значения от 0 до (n–1). Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s (l=0), p (l=1), d (l=2), f (l=3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
Буквенные обозначения энергетических подуровней:
Значение l |
0 |
1 |
2 |
3 |
|
Обозначение |
s |
p |
d |
f |
|
подуровней |
|||||
|
|
|
|
Для каждого значения главного квантового числа орбитальное число принимает значения, заключенные между 0 и (n-1).
Главное |
квантовое |
Орбитальное квантовое |
Обозначение орбитали |
число n |
|
число l |
(электронного облака) |
1 |
|
0 |
1s |
|
|
|
|
2 |
|
0, 1 |
2s, 2p |
|
|
|
|
3 |
|
0, 1, 2 |
3s, 3p, 3d |
|
|
|
|
4 |
|
0, 1, 2, 3 |
4s, 4p, 4d, 4f |
|
|
|
|
При обозначении состояния электрона главное квантовое число пишут перед символом орбитального квантового числа. Например, 4s означает электрон, у которого n=4 и l=0 (облако имеет форму шара); 2р означает электрон, у которого n=2 и l=1 (облако имеет форму гантели).
Форма s-электронного облака. Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции Ψ расположен по одну сторону от оси абсцисс (рисунок 7.2), т.е. волновая функция s-электрона положительна.
99
Рис. 7.2. График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
Форма p-электронного облака. Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб (рисунок
3.2). По одну сторону от ядра Ψ положительна, а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В
начале координат Ψ обращается в нуль. В отличие от s-орбитали, p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель (рисунок 7.3).
Рис. 7.3. График волновой функции p-электрона. Форма p-электронного облака
Знаки “+” и “–” относятся не к вероятности нахождения электрона (она всегда положительна и равна |Ψ|2), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
Еще более сложную форму имеют электронные облака d- и f- электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются:
100
