
andruhova
.pdf
4.Катионы активных металлов из раствора электролита не восстанавливаются. Они могут быть восстановлены только из расплава соли.
АНОДНЫЕ ПРОЦЕССЫ
Характер реакций, протекающих на аноде, зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод. Обычно аноды подразделяются на нерастворимые (инертные) и растворимые. Первые изготавливаются из угля, графита, платины, иридия; вторые – из меди, серебра, цинка, кадмия, никеля и других металлов.
На нерастворимом (инертном) аноде в процессе электролиза происходит либо окисление анионов либо молекул воды. Возможность протекания того или иного окислительного процесса определяется природой аниона и его «выделительным» потенциалом Евыд.
Величины выделительных потенциалов возрастают в следующем ряду: Легкость разряда анионов убывает
I─ Br─ Cl─ S2─ OH─ NO3─ SO42─ PO43─ F─
Чем меньше выделительный потенциал, тем легче ион отдает электрон.
1.При электролизе растворов бескислородных кислот и их солей (кроме HF) на аноде идет процесс окисления аниона:
An─ ─ ne → А0
2.При электролизе щелочей, кислородсодержащих кислот и их солей, а также HF и ее солей происходит электрохимическое окисление воды:
В щелочной среде: |
4OH─ ─ 4e- → 2H2O + O2↑ |
В кислой и нейтральной среде: 2H2O ─ 4e- → O2↑ + 4H+
161
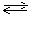
Пример: электролиз раствора NaCl на инертном аноде В растворе соли
находятся ионы соли и воды: |
|
|
|
|
|||
NaCl Na+ + Cl─ |
|
|
|
|
|||
Н2О |
Н+ + ОН─ |
|
|
|
|
||
Катод (─) ← Na+, Н2О |
|
2H2O + 2e → H2↑+ 2OH─ |
|||||
|
|||||||
|
|
|
|
|
|
|
|
Анод (+) |
← Сl─, Н2О |
|
2Cl– ─ 2e– →Cl2↑ |
||||
|
|
|
|
|
|||
Суммарная реакция: |
|
2H2O + 2Cl– = H2↑+ Cl2↑+ 2OH─ |
|||||
|
|
|
2H2O + 2NaCl = H2↑+ Cl2↑+ 2NaOH |
||||
Так как натрий активный металл, на катоде будет идти восстановление водорода из воды, а в прикатодном пространстве - накопление ионов OH─, которые взаимодействуют с ионами Na+ с образованием NaOH. На аноде разряжаются бескислородные анионы хлора, т.к. выделительный потенциал Сl─ меньше, чем у воды. Продуктами электролиза является молекулярный водород, молекулярный хлор и NaOH.
В случае электролиза с растворимым (активным) анодом число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона и электрохимическое окисление металла анода (анодное растворение металла). Из этих возможных процессов энергетически более выгоден процесс окисления материала анода:
Ме – ne– 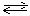 Меn+
Меn+
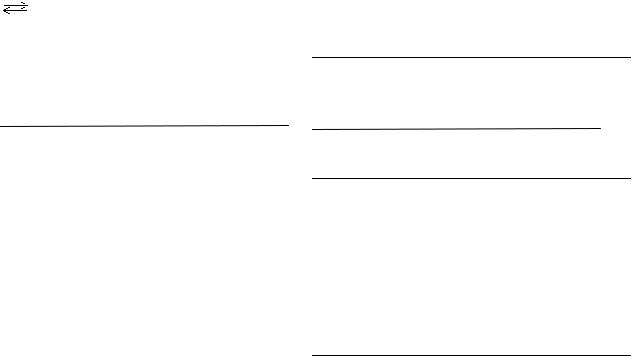
Рассмотрим электролиз водного раствора CuSO4 c графитовым и медным анодами.
162
|
|
|
Электролиз водного раствора CuSO4 |
|
|
|
|
|||||
|
|
|
|
CuSO4 |
|
Cu2+ + SO42─ |
|
|
|
|
|
|
|
|
|
|
Н2О |
|
|
Н+ + ОН─ |
|
|
|
|
|
|
|
|
|
|
|
Медный анод |
|
|||||
|
Графитовый анод |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||
К:(─) ← Cu2+, Н2О |
|
Cu2++ 2e- → Cu0 |
|
|
К:(─) ← Cu2+, Н2О |
|
Cu2+ + 2e → Cu0 |
|||||
|
|
|
|
|||||||||
А:(+)←SO42─, H2O |
|
2H2O ─ 4e-→ O2↑ + 4H+ |
|
А:(+)←Cu0, SO42─, H2O |
|
Cu0 ─2e → Cu2+ |
||||||
|
|
электролиза |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Продукты |
|
|
|
|
|
|||
|
|
|
|
|
|
Cu0 CuSO4 |
|
|
||||
|
Cu0 O2↑ Н2SO4 |
|
|
|
|
|
||||||
На катоде |
происходит |
восстановление |
|
На катоде происходит |
восстановление |
|||||||
малоактивного |
|
металла, |
т.к. |
его |
|
малоактивного |
металла, |
т.к. |
его |
|||
электродный потенциал больше, чем у |
|
электродный потенциал больше, чем у |
||||||||||
водорода. |
На |
|
аноде |
происходит |
|
водорода. На аноде происходит окисление |
||||||
электрохимическое окисление воды, т.к. |
|
металла, т.к. этот процесс энергетически |
||||||||||
кислородсодержащие кислотные остатки не |
|
более выгоден. |
|
|
|
|
|
|||||
могут окисляться в присутствии воды. |
|
|
|
|
|
|
|
|
||||
10.4.ЗАКОНЫ ЭЛЕКТРОЛИЗА
Сколичественной стороны процесс электролиза впервые был изучен в 30-х годах 19 века М. Фарадеем, установившим следующие законы электролиза.
Первый закон Фарадея. Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству прошедшего через электролит электричества.
m =K·Q или m =K·I·t,
где K – электрохимический эквивалент, зависит от природы вещества; Q – количество электричества, Кл;
I – сила тока, А;
t – время прохождения тока, сек.
Если Q = 1 Кл, то m = K – физический смысл электрохимического эквивалента.
163

Второй закон Фарадея. При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Измерениями было установлено, что 1 эквивалент любого вещества можно выделить, если пропустить через электролит 1 Фарадей электричества.
Эти два закона можно объединить в одном уравнении:
m = |
M |
I t |
, |
V = |
Vм |
It |
|
nF |
nF |
||||||
|
|
|
|
|
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе; F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А; t – время, с;
M – молярная масса выделяющегося вещества, г/моль; VМ – молярный объем газа (22,4 л/моль);
V – объем выделяющегося газа, л
Величина К= nFM называется электрохимическим эквивалентом
вещества. Если продолжительность электролиза измерять в часах, то число Фарадея должно быть выражено в ампер-часах. В этом случае F=26,8
А ч/моль.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы вещества, реально выделенного на электроде, к теоретической и умноженное на 100%, называют выходом по току:
η = mпр 100% .
mтеор.
164
ТЕМА 11. КОРРОЗИЯ МЕТАЛЛОВ
11.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
Коррозия – это самопроизвольное разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
В основе коррозийных процессов лежат окислительновосстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние (с уменьшением энергии Гиббса системы G<0). Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве.
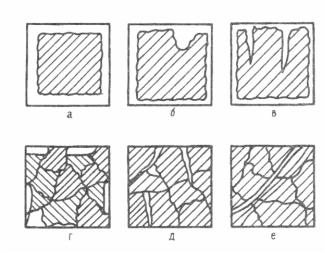
Механизм протекания коррозионного процесса в разных условиях различен (рис. 11.1), но по характеру разрушения поверхности металла
коррозию можно разделить на равномерную и местную.
Равномерная, или общая, коррозия распределяется более или менее равномерно по всей поверхности металла, в то время как местная коррозия сосредоточена на отдельных участках и проявляется в виде точек, язв или пятен. Местная коррозия, как правило, более опасна чем равномерная коррозия, так как процесс проникает на большую глубину.
Особыми видами коррозии являются межкристаллическая коррозия (коррозия по границам зерен), избирательная коррозия (растворение одного из компонентов сплава) и транскристаллическая, возникающая под действием механических напряжений и приводящая к развитию трещин.
Скорость коррозии выражают несколькими способами. Наиболее часто пользуются массовыми и глубинными показателями коррозии. Первый из них дает потерю массы (в граммах или килограммах) за единицу времени
165
(секунду, час, сутки, год), отнесенную к единице площади (квадратный метр) испытуемого образца. Глубинный показатель коррозии выражается
Рис.11.1. Виды коррозионных разрушений: а – равномерное; б – местное; в – точечное; г – избирательное; д – межкристаллическое; е- транскристаллическое.
уменьшением толщины металла в единицу времени. Скорость электрохимической коррозии можно также выразить величиной тока, приходящегося за единицу площади металла.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
11.2. Химическая коррозия
Химическая коррозия – разрушение металла его окислением в окружающей среде без возникновения электрического тока в системе.
При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают:
1.Газовая коррозия – взаимодействие металлов с различными газами (О2, F2, H2S, SO2 и др.) при высокой температуре. В
результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др. В зависимости
166
от свойств образующихся продуктов может происходить торможение процесса окисления.
Примером может служить окисление металла кислородом воздуха при высоких температурах. Так, на железе уже при 250-300 0С появляется видимая пленка оксидов. При 600 0С и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления: FeO, Fe3O4, Fe2O3. Окалина не защищает железо от дальнейшего окисления, так как содержит трещины и поры, которые облегчают доступ кислорода к металлу. Поэтому при нагревании железа свыше 800 0С скорость окисления его очень быстро растет.
Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т.п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке.
2.Коррозия в неэлектролитах – агрессивных неводных органических жидкостях. Так, металлы разрушаются в полностью обезвоженной нефти и продуктах ее переработки, если в них содержатся сероводород, серосодержащие продукты.
11.3. Электрохимическая коррозия
Электрохимическая коррозия – разрушение металла в среде электролита с возникновением внутри системы электрического тока.
Электрохимическое взаимодействие включает анодное окисление металла и катодное восстановление окислителя. Процесс анодного
растворения металла и составляет суть электрохимической коррозии.
Практически любой металл содержит примеси других металлов. Поэтому в среде электролита система из основного металла и металлапримеси образует большое число локальных микрогальванических элементов
– гальванопар.
167
ОСНОВНАЯ СХЕМА ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро-, а макрогальванопара, и коррозия называется контактной. Сочетания металлов, сильно отличающиеся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите (рисунок 11.2). Два металла в контакте. На поверхности тончайшая пленка воды. Возникает гальванический элемент, в котором отрицательным электродом является более активный металл. Так как соприкосновение металлов тесное, элемент замкнут и непрерывно работает.
Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окисления ионы переходят в электролит, а часть освободившихся при этом
168
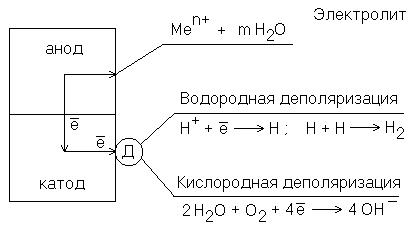
электронов может перемещаться к катодному участку (на рисунке показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов, и работа коррозионного гальванического элемента прекратится.
Рисунок 11.2. Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами.
По характеру катодного процесса различают коррозию с водородной и кислородной деполяризацией. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией.
Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом
(E° = –0,44В), а медь – катодом (E°=+0,34В).
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
169
На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe2+ – окисление К: 2H+ + 2e → H2↑ – восстановление
Железо, окисляясь, переходит в раствор в виде ионов Fe2+, образуя с хлоридионами среды хлорид железа (II) FeCl2 :
Fe2+ + 2Cl─ = FeCl2
В нейтральной среде коррозия протекает с кислородной деполяризацией.
Роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то на катоде протекает процесс восстановления кислорода, растворенного в электролите.
Схема короткозамкнутого гальванического элемента:
А (–) Fe | H2O, O2 | Cu (+) К |
|
(А) Fe – 2e → Fe2+ |
– окисление |
(К) 2H2O + O2 + 4e → 4OH– |
– восстановление |
У поверхности металла в электролите протекают следующие реакции:
Fe2+ + 2OH– → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
170
