
andruhova
.pdfна катализаторе оксиде ванадия V2O5 возрастает в сотни раз при добавлении
всистему сульфатов щелочных металлов.
Втоже время имеются вещества, которые ухудшают каталитическую активность. Их называют каталитическими ядами. Например, каталитическими ядами платиновых катализаторов являются соединения серы, мышьяка, ртуть.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ – катализатор и реагенты образуют одну фазу (газ или раствор).
Гетерогенный катализ – катализатор находится в системе в виде самостоятельной фазы.
Гетерогенными обычно являются твердые катализаторы, на поверхности которых реагируют газообразные или жидкие вещества. Активность катализатора зависит от величины и свойств его поверхности. Молекулы реагентов адсорбируются (адсорбция – явление концентрирования вещества из объема фаз на поверхности раздела фаз) на поверхности катализатора, что позволяет им затем легче превращаться в активированный комплекс.
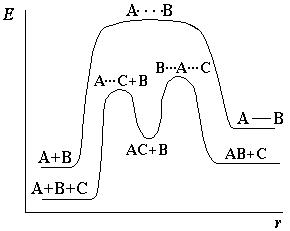
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции (рисунок 4.4).
А+ В → АВ – некаталитическая реакция
А+ С + В → АС + В → АВ + С – каталитическая реакция
(С – катализатор)
В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без
51
катализатора. Таким некоторые молекулы, столкновений, теперь реакции возрастает.
образом, энергия активации реакции понижается; энергия которых была недостаточна для активных оказываются активными. В результате скорость
В некоторых случаях каталитические реакции протекают с образованием не одного, а двух и более активированных комплексов. Однако суммарная энергия активации каталитического процесса ниже, чем энергия активации некаталитического процесса.
Рис. 4.4. – Энергетическая диаграмма каталитической реакции в сравнении с некаталитической
В химической промышленности приблизительно ¾ всех производств основаны на применении катализаторов. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. К наиболее распространенным промышленным катализаторам относятся Pt, Pd, Rh, Fe, Ni, CuO, RuO2, V2O5, NiO, Fe2O3, ZnO, SiO2, Cr2O3, Al2O3, Ag2O,
алюмосиликаты. Их используют при получении аммиака, азотной и серной кислот, метанола, водорода, хлора, этилена и других продуктов химической промышленности, при крекинге углеводородов, получении маргарина. Дальнейшее расширение каталитических процессов и улучшение катализаторов обеспечит экономию энергии и сырья. Например, применение нового катализатора в реакции синтеза метанола позволило снизить давление
52
в 10 раз, а температуру с 350 до 270 0С. Катализ используется в решении экологических задач, например, при очистке выбросов автомобилей и сточных вод.
Знание скоростей химических реакций имеет большое научное и практическое значение. Например, в химической промышленности при производстве веществ от скорости химической реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта. При практическом использовании важно знать, как изменить условия, чтобы реакция протекала с требуемой скоростью.
53
ТЕМА 5. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
5.1. Необратимые и обратимые реакции
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца (при химическом взаимодействии хотя бы одно из исходных веществ расходуется полностью). В обратимых реакциях ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Рассмотрим два примера.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O.
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится – данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой – необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению: N2 + 3H2  2NH3.
2NH3.
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если
54
теперь в те же условия в качестве исходного вещества поместить не азотноводородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количеством всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака – обратимая реакция.
5.2. Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород.
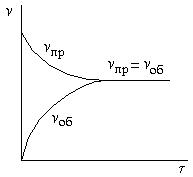
На рисунке 5.1 показано изменение скоростей прямой и обратной реакций с течением времени. Вначале, при смешении исходных веществ, скорость прямой реакции vпр велика, а скорость обратной реакции vоб равна нулю.
Рис.5.1. Зависимость скоростей прямой и обратной реакций от времени τ.
По мере протекания реакции исходные вещества расходуются, и их концентрации падают. Одновременно появляются продукты реакции, их концентрации возрастают. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и
обратной реакций становятся одинаковыми, наступает химическое
55
равновесие. Химическое равновесие – это равновесие динамическое, при котором происходит непрерывное образование и распад молекул. Причём в единицу времени число распавшихся молекул равно числу образовавшихся молекул.
Необратимых реакций меньше, чем обратимых. Примером обратимой реакции может служить взаимодействие Н2 и I2:
Н2 + I2  2HI
2HI
Взаимодействие Н2 с парами I2 сначала идёт со сравнительно большой скоростью Vпр в сторону образования HI:
Vпр = kпр·[H2] [I2]
По мере накопления HI всё с большей скоростью начинает протекать обратный процесс – разложение HI на Н2 и I2:
Vобр = kобр·[HI]2
Через некоторое время скорость образования HI становится равной скорости его разложения, т.е., Vпр = Vобр иными словами, наступает
химическое равновесие.
Равенство Vпр = Vобр является кинетическим условием химического равновесия, а равенство = 0 – термодинами ческим условием
химического равновесия. Если GP, t = 0, Vпр = Vобр при данной температуре и давлении (p = const, t = const). Неравенству GP, t < 0 отвечает Vпр > Vобр, в системе самопроизвольно идёт прямая реакция, накапливаются продукты реакции, и наоборот.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия (К). В общем виде для гомогенной реакции: аА + вВ → сС + dD
Vпр = kпр·[А]а [В]в ; Vпр = kобр·[С]с [D]d; Vпр = Vобр, следовательно kпр·[А]а [В]в = kобр·[С]с [D]d;
Разделим обе части равенства на kпр·[А]а [В]в, и получим К – константу равновесия.:
56

kïð |
= |
[C]c [D]d |
= K |
|
kîáð |
|
[A]a [B]b |
||
|
|
|
||
Отношение констант скорости прямой и обратной реакций (K) называется константой равновесия. Концентрации реагентов и продуктов в условиях равновесия называются равновесными концентрациями.
Константа равновесия представляет собой постоянную (при данной температуре) величину, показывающую соотношение между концентрациями продуктов реакции (числитель) и реагентов (знаменатель), которое устанавливается при равновесии. Величина K зависит от природы реагирующих веществ и от температуры.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собою изменение концентраций всех остальных веществ. В итоге, устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Если К » 1, выход реакции велик, а если К«1, то выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение ЗДМ входят концентрации только тех веществ, которые находятся в газовой или жидкой фазах.
Например, для реакции: С(ТВ) + СО2(Г) = 2СО(Г) константа равновесия
будет иметь следующее значение: К = [CO]2
[CO2 ]
5.3. Смещение химического равновесия. Принцип Ле-Шателье
Система находится в состоянии равновесия до тех пор, пока внешние условия (Т, Р, С) сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия – скорости прямого и обратного процессов изменятся неодинаково – будет протекать реакция.
57
равновесия: К = |
[HI ]2 |
|
|
При увеличении концентрации Н2 должна возрасти и |
|
[H 2 ][I |
2 ] |
||||
|
|
||||
концентрация НI. Это следует из того, что К-величина постоянная.
58
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
5.3.2. Влияние давления
Давление имеет существенное влияние при реакциях между газами. Изменение давления влияет на состояние равновесия в тех случаях, когда реакция сопровождается изменением объёма системы.
Рассмотрим влияние давления на реакцию между монооксидом азота и кислородом:
2NO + O2 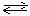 2NO2
2NO2
До увеличения давления концентрации газов имеют равновесные значения [NO], [O2], [NO2], а скорости прямой и обратной реакций одинаковы и определяются уравнениями:
vпр=kпр [NO]2 [O2]; vобр=kобр [NO2]2
Если увеличить вдвое давление в закрытом реакционном сосуде, то объём уменьшится в два раза, а значит, соответственно, увеличится вдвое концентрация газов по сравнению с их исходными значениями: 2[NO], 2[O2], 2[NO2]. При этом скорости прямой и обратной реакций будут определятся уравнениями:
v/пр=kпр (2[NO])2 2[O2] = 8 kпр [NO]2 [O2] = 8vпр
v/обр=kобр (2[NO2])2 = 4 kобр [NO2]2 = 4vобр
Таким образом, в результате увеличения давления в 2 раза скорость прямой реакции возросла в 8 раз, а обратной – только в 4 раза. Равновесие в системе нарушается, прямая реакция преобладает над обратной: vпр > vобр, равновесие сместится вправо.
59
Нетрудно видеть, что неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и правой частях уравнения рассматриваемой реакции различно число молекул газов: одна молекула кислорода и две молекулы монооксида азота (всего три молекулы газов) превращаются в две молекулы газа – диоксида азота, т.е. данная реакция протекает с уменьшением числа молекул газа. В данном случае, при увеличении давления равновесие смещается в сторону уменьшения числа молекул газа.
Всвязи с этим, вывод о влиянии давления на химическое равновесие можно сформулировать следующим образом:
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается
всторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
Втом случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе Н2 + I2 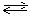 2HI равновесие не нарушается при изменении объёма; выход HI не зависит от давления.
2HI равновесие не нарушается при изменении объёма; выход HI не зависит от давления.
5.3.3. Влияние температуры
Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции. Согласно принципу Ле Шателье:
При повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
60
