
- •2. Ускорение при плоском криволинейном движении. Нормальное и тангенсальное ускорения.
- •3. Кинематика вращения твёрдого тела вокруг закреплённой оси. Угол поворота. Угловая скорость. Угловое ускорение. Связь между линейной и угловой скоростью. Равноускоренное движение.
- •4. Законы Ньютона. Принцип относительности Галилея.
- •5. Упругие силы. Силы трения.
- •6. Закон всемирного тяготения. Сила тяжести. Вес тела. Состояние невесомости.
- •7. Импульс. Импульс силы. Закон сохранения импульса. Центр масс.
- •8. Механическая работа. Мощность. Энергия. Кинетическая энергия.
- •9. Поле сил. Консервативные силы. Потенциальная энергия. Связь между потенциальной энергией и силой.
- •10. Закон сохранения полной механической энергии частицы.
- •11. Закон сохранения энергии для системы невзаимодействующих частиц.
- •12. Взаимная потенциальная энергия частиц. Закон сохранения энергии системы частиц.
- •13. Энергия упругой деформации. Условия равновесия механической системы.
- •14. Момент импульса. Момент силы. Потенциальная энергия. Связь между потенциальной энергией и силой.
- •15. Вращение твёрдого тела вокруг закреплённой оси. Основное уравнение динамики вращательного движения твёрдого тела.
- •16. Момент инерции. Вычисление моментов инерции ноторых тел относительно оси симметрии (тонкий стержень, обруч, диск). Теорема Штейнера.
- •17. Момент инерции однородного тела вращения. Моменты инерции конуса, шара.
- •18. Кинетическая энергия вращающегося твёрдого тела вокруг закреплённой оси. Кинетическая энергия твёрдого тела при плоском движении.
- •19. Уравнения динамики твёрдого тела. Центр тяжести. Условия равновесия твёрдого тела.
- •20. Колебательное движение. Кинематика и динамика гармонических колебаний.
- •21. Кинетическая и потенциальная энергия гармонического колебания. Полная энергия гармонического колебания. Средние за период значения кинетической и потенциальной энергии.
- •22. Математический и физический маятники. Приведённая длина физического маятника. Центр качаний.
- •23. Сложение гармонических колебаний одного направления. Сложение взаимно перпендикулярных колебаний.
- •24. Затухающие колебания. Логарифмический декремент затухания. Добротность колебательной системы.
- •25. Вынужденные колебания. Явление резонанса. Резонансные кривые.
- •26. Основные понятия и исходные положения положения термодинамики. Обратимые и необратимые процессы. Круговые процессы (циклы).
- •27. Внутренняя энергия. Работа и теплота. Первое начало термодинамики.
- •28. Теплоёмкость. Молярная и удельная теплоёмкости. Связь между ними. Формула Майера.
- •29. Уравнение состояния идеального газа. Изотермический, изохорический и изобарический процессы и их уравнения. Графики этих процессов.
- •30. Адиабатический процесс. Уравнение Пуассона. Показатель адиабаты.
- •31. Политропические процессы. Уравнение политропы идеального газа. Показатель политропы.
- •32. Тепловые двигатели. К.П.Д. Теплового двигателя. Холодильный коэффицент. Различные формулировки второго начала термодинамики.
- •33. Цикл Карно. Первая теорема Карно. Вторая теорема Карно.
- •34. Рабочий цикл четырёхтактного двигателя внутреннего сгорания. К.П.Д. Цикла.
- •35. Рабочий цикл четырёхтактного двигателя внутреннего сгорания Дизеля. К.П.Д. Цикла.
- •36. Неравенство Клаузиуса. Равенство Клаузиуса. Энтропия. Изэнтропический процесс. Теорема Нернста(третье начало термодинамики).
- •37. Закон возрастания энтропии. Основное уравнение термодинамики.
- •38. Число степеней свободы механической системы. Поступательные, вращательные и колебательные степени свободы молекулы. Теорема о равнораспределении энергии по степеням свободы.
- •39. Классическая теория теплоёмкости идеальных газов.
- •40. Классическая теория теплоёмкости твёрдых тел (кристаллов). Закон Дюлонга и Пти.
- •41. Пространство скоростей. Функция распределения молекул по скоростям. Распределение Максвелла.
- •42. Распределение молекул по абсолютным значениям скоростей. Характерные скорости (наиболее вероятная, средняя, среднеквадратичная) в распределении Максвелла.
- •43. Барометрическая формула. Распределение Больцмана. Распределение Максвелла - Больцмана.
- •44. Энтропия и вероятность. Формула Больцмана. Макро- и микросостояния. Термодинамическая вероятность макросостояния (статистический вес).
40. Классическая теория теплоёмкости твёрдых тел (кристаллов). Закон Дюлонга и Пти.
Закон Джоуля-Коппа описывает теплоёмкость сложных (т.е. состоящих из нескольких химических элементов) кристаллических тел. Основан на законе Дюлонга-Пти. Каждый атом в молекуле имеет
три
колебательных степени свободы, и он
обладает энергией
![]() .
Соответственно, молекула из n атомов
обладает в n раз большей энергией:
.
Соответственно, молекула из n атомов
обладает в n раз большей энергией:![]()
Молярная
теплоёмкость вещества равна:
![]()
то есть она в n раз больше теплоёмкости кристалла с одноатомными молекулами. Иными словами, молярная теплоёмкость вещества равна сумме теплоёмкостей составляющих его химических элементов. Важно отметить, что закон Джоуля-Коппа выполняется даже для кристаллов, содержащих в своей структуре не подчиняющиеся закону Дюлонга-Пти химические элементы.
Закон
Дюлонга-Пти
(Закон
постоянства теплоёмкости)
— эмпирический
закон,
согласно которому молярная
теплоёмкость
твёрдых тел при комнатной температуре
близка к 3R:![]() где
R
— универсальная
газовая постоянная.
где
R
— универсальная
газовая постоянная.
Закон
выводится в предположении, что
кристаллическая решетка тела состоит
из атомов, каждый из которых совершает
гармонические
колебания
в трех направлениях, определяемыми
структурой решетки, причем колебания
по различным направлениям абсолютно
независимы друг от друга. При этом
получается, что каждый атом представляет
три
осциллятора
с энергией E,
определяемой следующей формулой:![]() .
.
Формула
вытекает из теоремы о равнораспределении
энергии
по степеням свободы. Так как каждый
осциллятор имеет одну степень
свободы,
то его средняя кинетическая
энергия
равна K=kt/2,
а так как колебания происходят
гармонически, то средняя потенциальная
энергия
равна средней кинетической, а полная
энергия - соответственно их сумме. Число
осцилляторов в одном моле вещества
составляет
![]() ,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
,
их суммарная энергия численно равна
теплоемкости тела - отсюда и вытекает
закон Дюлонга-Пти.
41. Пространство скоростей. Функция распределения молекул по скоростям. Распределение Максвелла.
пространство
скоростей- это, когда в качестве осей
координат выступают скорости по
соответствующим осям координат в
псевдоевклидовом пространстве.
Т.е.:
скорости![]() . (координата времени
присутствует в не явном виде), так как
координаты не однородные.
. (координата времени
присутствует в не явном виде), так как
координаты не однородные.
Распределение Ма́ксвелла— распределение вероятности, оно применимо к множеству свойств индивидуальных молекул в газе.
О нём обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул.
функция распределения молекул газа по скоростям:
![]()
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
![]()
где
![]() является
числом молекул имеющих энергию
является
числом молекул имеющих энергию![]() при
температуре системыT,
Nявляется
общим числом молекул в системе и k,
— постоянная Больцмана.
при
температуре системыT,
Nявляется
общим числом молекул в системе и k,
— постоянная Больцмана.
Распределение по вектору импульса:
![]()
Распределение по абсолютной величине импульса:
![]()
42. Распределение молекул по абсолютным значениям скоростей. Характерные скорости (наиболее вероятная, средняя, среднеквадратичная) в распределении Максвелла.
Аналогичная неравномерность имеет место и в распределении частиц в газе по скоростям. Случайный обмен импульсами и энергиями частиц при столкновениях приводит к некоторому разбросу кинетических энергий и скоростей молекул вокруг их средних значений, соответствующих установившейся в газе температуре. Случайные изменения скоростей молекул в результате столкновений можно рассматривать как случайное блуждание частиц, но не в реальном координатном пространстве, а в пространстве скоростей, осями в котором являются скорости частиц vx, vу, vz (рис.).
П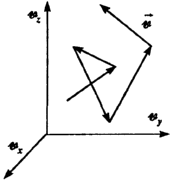 оэтому
все сказанное о хаотическом тепловом
движении в реальном пространстве
применимо и к распределению частиц по
скоростям.
оэтому
все сказанное о хаотическом тепловом
движении в реальном пространстве
применимо и к распределению частиц по
скоростям.
Наиболее вероятная величина скорости в газе — скорость vm.
![]() .
.
Средняя
скорость :
![]()
Cреднеквадратичной
скорости
![]()
Все эти средние скорости близки друг другу.
