
- •2. Ускорение при плоском криволинейном движении. Нормальное и тангенсальное ускорения.
- •3. Кинематика вращения твёрдого тела вокруг закреплённой оси. Угол поворота. Угловая скорость. Угловое ускорение. Связь между линейной и угловой скоростью. Равноускоренное движение.
- •4. Законы Ньютона. Принцип относительности Галилея.
- •5. Упругие силы. Силы трения.
- •6. Закон всемирного тяготения. Сила тяжести. Вес тела. Состояние невесомости.
- •7. Импульс. Импульс силы. Закон сохранения импульса. Центр масс.
- •8. Механическая работа. Мощность. Энергия. Кинетическая энергия.
- •9. Поле сил. Консервативные силы. Потенциальная энергия. Связь между потенциальной энергией и силой.
- •10. Закон сохранения полной механической энергии частицы.
- •11. Закон сохранения энергии для системы невзаимодействующих частиц.
- •12. Взаимная потенциальная энергия частиц. Закон сохранения энергии системы частиц.
- •13. Энергия упругой деформации. Условия равновесия механической системы.
- •14. Момент импульса. Момент силы. Потенциальная энергия. Связь между потенциальной энергией и силой.
- •15. Вращение твёрдого тела вокруг закреплённой оси. Основное уравнение динамики вращательного движения твёрдого тела.
- •16. Момент инерции. Вычисление моментов инерции ноторых тел относительно оси симметрии (тонкий стержень, обруч, диск). Теорема Штейнера.
- •17. Момент инерции однородного тела вращения. Моменты инерции конуса, шара.
- •18. Кинетическая энергия вращающегося твёрдого тела вокруг закреплённой оси. Кинетическая энергия твёрдого тела при плоском движении.
- •19. Уравнения динамики твёрдого тела. Центр тяжести. Условия равновесия твёрдого тела.
- •20. Колебательное движение. Кинематика и динамика гармонических колебаний.
- •21. Кинетическая и потенциальная энергия гармонического колебания. Полная энергия гармонического колебания. Средние за период значения кинетической и потенциальной энергии.
- •22. Математический и физический маятники. Приведённая длина физического маятника. Центр качаний.
- •23. Сложение гармонических колебаний одного направления. Сложение взаимно перпендикулярных колебаний.
- •24. Затухающие колебания. Логарифмический декремент затухания. Добротность колебательной системы.
- •25. Вынужденные колебания. Явление резонанса. Резонансные кривые.
- •26. Основные понятия и исходные положения положения термодинамики. Обратимые и необратимые процессы. Круговые процессы (циклы).
- •27. Внутренняя энергия. Работа и теплота. Первое начало термодинамики.
- •28. Теплоёмкость. Молярная и удельная теплоёмкости. Связь между ними. Формула Майера.
- •29. Уравнение состояния идеального газа. Изотермический, изохорический и изобарический процессы и их уравнения. Графики этих процессов.
- •30. Адиабатический процесс. Уравнение Пуассона. Показатель адиабаты.
- •31. Политропические процессы. Уравнение политропы идеального газа. Показатель политропы.
- •32. Тепловые двигатели. К.П.Д. Теплового двигателя. Холодильный коэффицент. Различные формулировки второго начала термодинамики.
- •33. Цикл Карно. Первая теорема Карно. Вторая теорема Карно.
- •34. Рабочий цикл четырёхтактного двигателя внутреннего сгорания. К.П.Д. Цикла.
- •35. Рабочий цикл четырёхтактного двигателя внутреннего сгорания Дизеля. К.П.Д. Цикла.
- •36. Неравенство Клаузиуса. Равенство Клаузиуса. Энтропия. Изэнтропический процесс. Теорема Нернста(третье начало термодинамики).
- •37. Закон возрастания энтропии. Основное уравнение термодинамики.
- •38. Число степеней свободы механической системы. Поступательные, вращательные и колебательные степени свободы молекулы. Теорема о равнораспределении энергии по степеням свободы.
- •39. Классическая теория теплоёмкости идеальных газов.
- •40. Классическая теория теплоёмкости твёрдых тел (кристаллов). Закон Дюлонга и Пти.
- •41. Пространство скоростей. Функция распределения молекул по скоростям. Распределение Максвелла.
- •42. Распределение молекул по абсолютным значениям скоростей. Характерные скорости (наиболее вероятная, средняя, среднеквадратичная) в распределении Максвелла.
- •43. Барометрическая формула. Распределение Больцмана. Распределение Максвелла - Больцмана.
- •44. Энтропия и вероятность. Формула Больцмана. Макро- и микросостояния. Термодинамическая вероятность макросостояния (статистический вес).
29. Уравнение состояния идеального газа. Изотермический, изохорический и изобарический процессы и их уравнения. Графики этих процессов.
Уравнение
состояния идеального газа
(иногда уравнение Клапейрона или
уравнение Клапейрона —
Менделеева) —
формула,
устанавливающая зависимость между
давлением, молярным объёмом и абсолютной
температурой идеального
газа.
Уравнение
имеет вид:![]()
![]() —
давление,
—
давление,![]() —
молярный объём,
—
молярный объём,
![]() —
абсолютная температура,
—
абсолютная температура,![]() —
универсальная газовая постоянная.Эта
форма записи носит имя уравнения (закона)
Менделеева —
Клапейрона:
—
универсальная газовая постоянная.Эта
форма записи носит имя уравнения (закона)
Менделеева —
Клапейрона:![]()
1. Изотермический процесс
П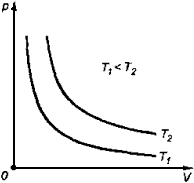 роцесс
изменения состояния термодинамической
системы при постоянной температуре
называют
изотермическим.
роцесс
изменения состояния термодинамической
системы при постоянной температуре
называют
изотермическим.
Если
Т =const, то
![]()
Закон Бойля-Мариотта
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется: p1V1=p2V2 при Т = const
График процесса, происходящего при постоянной температуре, называется изотермой.
2. Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
![]()
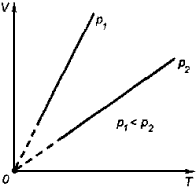
Закон Гей-Люссака
Объем данной массы газа при постоянном давлении прямо пропорционален абсолютной температуре:
![]()
Если
газ, имея объем V0
находится при нормальных условиях:
![]() а
затем при постоянном давлении переходит
в состояние с температурой Т и объемом
V, то можно записать
а
затем при постоянном давлении переходит
в состояние с температурой Т и объемом
V, то можно записать
![]()
Обозначив
![]()
получим
V=V0![]() T
T
Коэффициент
![]() называют
температурным коэффициентом объемного
расширения газов. График процесса,
происходящего при постоянном давлении,
называется изобарой.
называют
температурным коэффициентом объемного
расширения газов. График процесса,
происходящего при постоянном давлении,
называется изобарой.
3. Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Ecли V = const , то
![]()
Закон Шарля
Д авление
данной массы газа при постоянном объеме
прямо пропорционально абсолютной
температуре:
авление
данной массы газа при постоянном объеме
прямо пропорционально абсолютной
температуре:
![]()
Если газ, имея объем V0,находится при нормальных условиях:
![]()
а затем, сохраняя объем, переходит в состояние с температурой Т и давлением р, то можно записать
![]()
График процесса, происходящего при постоянном объеме, называется изохорой.
30. Адиабатический процесс. Уравнение Пуассона. Показатель адиабаты.
Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии.
Адиабатический процесс является частным случаем политропного процесса. Адиабатические процессы обратимы, если их проводить достаточно медленно (квазистатически). В общем случае адиабатический процесс необратим.
Уравнение Пуассона
Для идеальных газов адиабата имеет простейший вид и определяется уравнением:
pVk=const где:p— давление газа,V—
его объём,![]() —
показатель адиабаты,
—
показатель адиабаты,
CpиCv— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
При
адиабатическом процессе показатель
адиабаты равен
![]() где
R - универсальная газовая постоянная
где
R - универсальная газовая постоянная
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду: Tkp1 − k=const, где T — абсолютная температура газа.
Или к виду: Tvk − 1=const
Поскольку k всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (т.е. при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов.
